
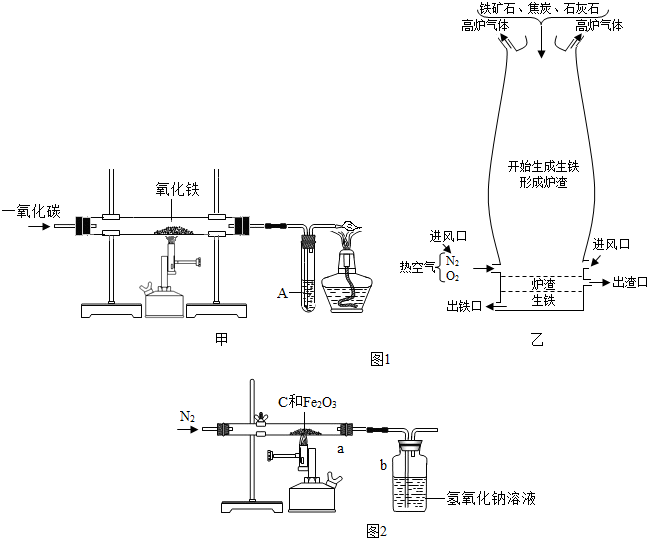
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| 160 |
| 112 |
| 1000t×80% |
| 96%x |


科目:初中化学 来源: 题型:阅读理解
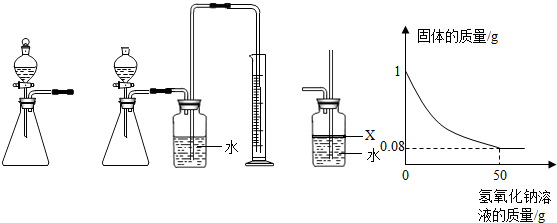
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 制取气体 | 所需药品 | 装置连接顺序 | 反应的化学方程式 |
| 氧气 | 氯酸钾和二氧化锰 | ||
| 二氧化碳(干燥) | 大理石和稀盐酸 |
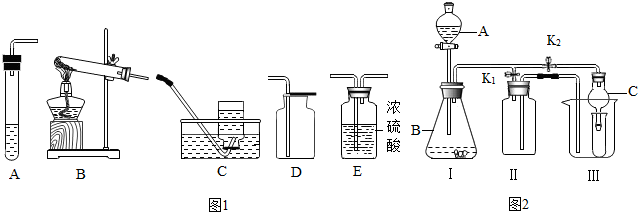
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
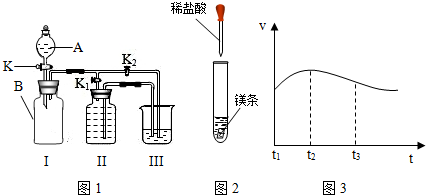
| ||
| ||
| 1 |
| 5 |
| 1 |
| 5 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2012届北京市海淀区中考二模化学试卷(带解析) 题型:探究题
在小组活动中,王老师演示了一个实验:将烘干的碳酸镁与锌粉按照一定比例研细混匀,按照图1进行实验。然后指导同学们对碳酸镁与锌粉发生的反应进行了实验探究。
【查阅资料】部分含有镁、锌元素物质的相关性质。
①氧化镁、氧化锌:均为白色固体,均与盐酸反应,生成无色盐溶液。
②碳酸镁、碳酸锌:均为白色固体,均与盐酸反应,生成无色盐溶液和二氧化碳气体。
【实验探究】
(1)实验一:碳酸镁与锌粉反应的气体产物是什么?
| 序号 | 实验操作 | 实验现象 |
| ① | 收集两瓶气体,盖好玻璃片。向其中一瓶迅速倒入少量澄清石灰水,盖好振荡。 | 无明显现象。 |
| ② | 将另一瓶气体点燃,待火焰熄灭后,迅速倒入少量澄清石灰水,盖好振荡。 | 气体安静燃烧,火焰呈蓝色,澄清石灰水变浑浊。 |
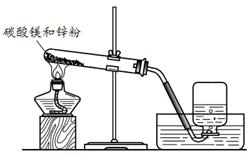
查看答案和解析>>
科目:初中化学 来源:2011-2012学年北京市海淀区中考二模化学试卷(解析版) 题型:探究题
在小组活动中,王老师演示了一个实验:将烘干的碳酸镁与锌粉按照一定比例研细混匀,按照图1进行实验。然后指导同学们对碳酸镁与锌粉发生的反应进行了实验探究。
【查阅资料】部分含有镁、锌元素物质的相关性质。
①氧化镁、氧化锌:均为白色固体,均与盐酸反应,生成无色盐溶液。
②碳酸镁、碳酸锌:均为白色固体,均与盐酸反应,生成无色盐溶液和二氧化碳气体。
【实验探究】
(1)实验一:碳酸镁与锌粉反应的气体产物是什么?
|
序号 |
实验操作 |
实验现象 |
|
① |
收集两瓶气体,盖好玻璃片。向其中一瓶迅速倒入少量澄清石灰水,盖好振荡。 |
无明显现象。 |
|
② |
将另一瓶气体点燃,待火焰熄灭后,迅速倒入少量澄清石灰水,盖好振荡。 |
气体安静燃烧,火焰呈蓝色,澄清石灰水变浑浊。 |
结论:碳酸镁与锌粉反应的气体产物是 。②中气体燃烧的化学方程式为 。
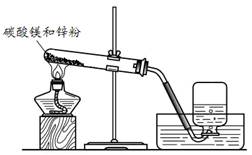
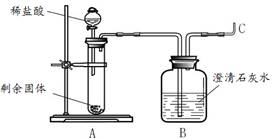
图1 图2
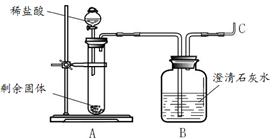
(2)实验二:碳酸镁与锌粉反应的固体产物是什么?
王老师将剩余固体分成2份,由甲、乙两组同学进行探究。
甲组同学将剩余固体直接按照图2进行实验,观察到A中有大量气泡生成,B中的澄清石灰水变浑浊,将产生的气体在C处验纯后点燃,观察到淡蓝色火焰。C处点燃的气体是 (填化学式)。甲组同学获得结论:该反应的固体产物是碳酸锌和镁。
乙组同学将剩余固体先进行了处理,然后也按照图2进行了实验,观察到A中固体溶解,生成无色溶液,B中没有明显变化。他们对剩余固体的处理操作是 。乙组同学利用质量守恒定律和实验现象,分析碳酸镁与锌粉发生反应后的固体产物是氧化锌和氧化镁,其理由是 。
(3)实验反思:老师看到两组同学的实验报告后,确定乙组的结论是正确的,碳酸镁与锌粉反应的化学方程式为 。同学们对甲组的实验过程再次进行了分析,由B、C处产生的现象,可以说明甲组放入试管A中的固体成分含有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com