


科目:初中化学 来源: 题型:阅读理解
| 实验方案 | 实验现象 | |
| 甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
| 乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变成黄绿色 |
| 丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
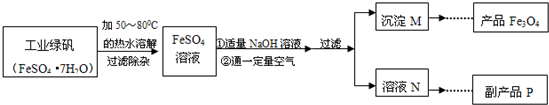
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
| ||
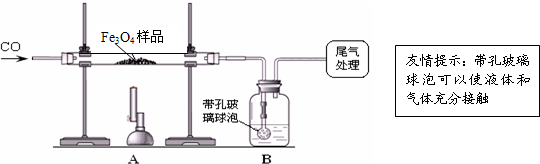
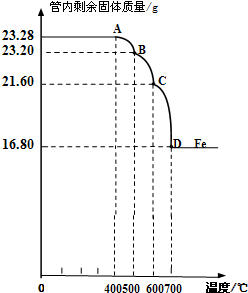 质量差会偏小而影响计算、分析,你认为他们的理由是
质量差会偏小而影响计算、分析,你认为他们的理由是
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
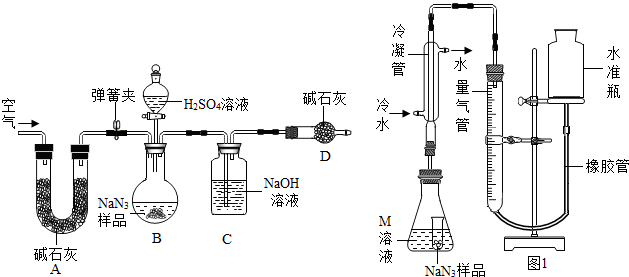
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
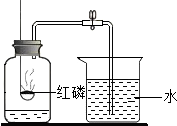 空气是一种重要的自然资源.通过半年的初中化学学习,我们可以从化学的视角来进一步认识空气.
空气是一种重要的自然资源.通过半年的初中化学学习,我们可以从化学的视角来进一步认识空气.
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验方案 | 实验现象 | |
| 甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
| 乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变成黄绿色 |
| 丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
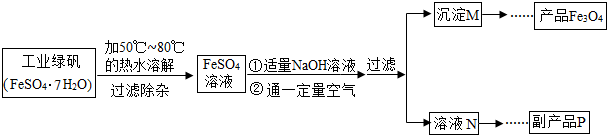
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
| ||
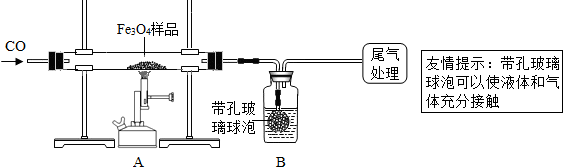
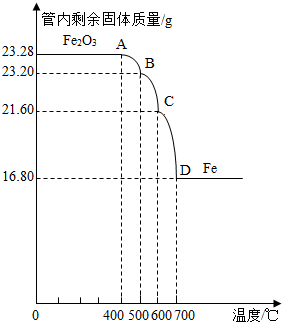
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 化学纯 盐酸 含HCl 37% 密度 1.18g.cm-3 容量 500mL XX化学试剂厂(3)若用F装置收集二氧化碳,则气体应从 m m 端(填m或n)进入;若将收集到的二氧化碳气体沿烧杯壁倒入D(蜡烛已点燃)中,出现的现象是下面的蜡烛先灭,上面的蜡烛后灭 下面的蜡烛先灭,上面的蜡烛后灭 ,该实验说明二氧化碳具有不燃烧,也不支持燃烧,密度比空气大 不燃烧,也不支持燃烧,密度比空气大 的性质.(4)实验室用装置A、C均能制取氧气,这两种方法中,最能体现“节能环保”理念的是(用化学方程式): 2H2O2
2H2O2 ,该反应中二氧化锰的作用是
催化剂 催化剂 ;实验室用装置E收集的氧气不纯,可能产生的原因是集气瓶中没有装满水,混有空气 集气瓶中没有装满水,混有空气 .
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |