
| 实验方法 | 可能观察到的现象和结论 |
| 实验方法 | 可能观察到的现象和结论 |
| 取少量浓度较小的氢氧化钠,滴入无色酚酞, | 若溶液变红色后,颜色不变,说明与氢氧化钠溶液浓度有关. |


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:初中化学 来源: 题型:阅读理解
 24、同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了.为此某化学小组的同学进行了如下探究.
24、同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了.为此某化学小组的同学进行了如下探究.| 实验步骤 | 实验目的 | 现象结论 |
| ①用煮沸过的蒸馏水配制某氢氧化钠溶液. | 排出水中溶解的氧气 | 溶液先变成红色,一会儿红色又消失. 丙同学的猜想不正确. |
| ②取少量上述氢氧化钠溶液,滴入酚酞,然后在上方滴一些植物油. | 隔绝空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究.
酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究.
| 实 验 操 作 | 实验现象 | 实 验 结 论 |
| 取少量氯化钠固体,放入 试管中,加水,振荡 |
固体溶解, 溶液呈无色 |
氯化铜溶液中的Cu2+能使溶液显蓝色(或Clˉ和水分子不能使氯化铜溶液显蓝); 氯化铜溶液中的Cu2+能使溶液显蓝色(或Clˉ和水分子不能使氯化铜溶液显蓝); |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?许昌一模)某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.
(2013?许昌一模)某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.| 实验内容 | 实验现象 | 解释与结论 |
| 取反应后少量溶液于试管中,加入 固体化台物 Na2CO3(或CaCO3), Na2CO3(或CaCO3), . |
有气泡产生 有气泡产生 |
盐酸过量 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验方案 | 甲 | 乙 | 丙 |
实验操作 |
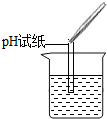 |
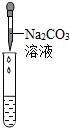 |
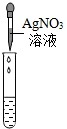 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 有气泡产生 |
产生白色沉淀 |
| 实验结论 | 溶液中有HCl | 溶液中有HCl | 溶液中有HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com