
【题目】我校九(1)班同学举行“是真的吗?”化学主题活动,请你和蓓蓓一起探究。
话题1:能被磁铁吸引的物质一定是铁单质吗?
【实验验证】①将细铁丝在纯氧中完全燃烧,主要反应的化学方程式为_________________;
②将反应后的黑色固体用磁铁检验,能被吸引。
【实验结论】能被磁铁吸引的物质_________(填“一定”或“不一定”)是铁单质。
话题2:含有Ba2+的盐一定有毒吗?
【社会调查】在医院检查肠胃疾病时,病人需服用“钡餐”(主要成分为BaSO4)。
【调查结论】“含有Ba2+的盐一定有毒”这句话是_____________(填“真的”或“假的”)。
【交流反思】若误服碳酸钡(BaCO3),胃酸的主要成分_____________(填化学式)会与之反应,形成可溶性钡盐,使人体内蛋白质变性而中毒,此时可服用_________(填一种即可)解毒。
话题3:向某溶液中先滴加足量稀硝酸,再滴加BaCl2溶液,产生白色沉淀,原溶液中一定含有SO42--吗?
【实验回顾】向AgNO3溶液中先滴加稀硝酸,再滴加BaCl2溶液,也产生白色沉淀,反应的化学方程式是_____________。
【实验结论】向某溶液中先滴加足量稀硝酸,再滴加BaCl2溶液,若产生白色沉淀,原溶液中不一定含有SO42-。
【拓展实验】向Na2SO4溶液中先滴加足量稀硝酸,再滴加BaCl2溶液,也产生白色沉淀。
【查阅资料】①硝酸具有强氧化性,向Na2SO3溶液中滴加稀硝酸时,发生如下反应:
![]()
②含有SO32-的盐统称为亚硫酸盐,亚硫酸盐都能与盐酸反应生成SO2气体。
【交流反思】①向某一种钠盐的溶液中先滴加足量稀硝酸,再滴加BaCl2溶液,产生白色沉淀。原溶液中阴离子可能是SO42-,还可能是_________(填离子符号)。
②下列实验方案中,能证明溶液里含有SO42-的是_________(填“A”或“B”)。
A.取样,先滴加BaCl2溶液,产生白色沉淀,再滴加稀盐酸,沉淀不溶解
B.取样,先滴加稀盐酸,无明显现象,再滴加BaCl2溶液,产生白色沉淀
【答案】话题1:【实验验证】①3Fe+2O2![]() Fe3O4。【实验结论】不一定。
Fe3O4。【实验结论】不一定。
话题2:【调查结论】假的。【交流反思】HCl 硫酸镁。
话题3:【实验回顾】BaCl2+2 AgNO3=2 AgCl↓+Ba﹙NO3﹚2
【交流反思】①SO32-②B
【解析】
试题分析∶根据所学知识和题中信息知,话题1:能被磁铁吸引的物质一定是铁单质吗?
【实验验证】①将细铁丝在纯氧中完全燃烧,主要反应的化学方程式为3Fe+2O2![]() Fe3O4②将反应后的黑色固体用磁铁检验,能被吸引。【实验结论】能被磁铁吸引的物质不一定是铁单质。话题2:含有Ba2+的盐一定有毒吗?【社会调查】在医院检查肠胃疾病时,病人需服用“钡餐”(主要成分为BaSO4)。【调查结论】“含有Ba2+的盐一定有毒”这句话是假的。【交流反思】若误服碳酸钡(BaCO3),胃酸的主要成分HCl会与之反应,形成可溶性钡盐,使人体内蛋白质变性而中毒,此时可服用硫酸镁解毒。话题3:向某溶液中先滴加足量稀硝酸,再滴加BaCl2溶液,产生白色沉淀,原溶液中一定含有SO42--吗?【实验回顾】向AgNO3溶液中先滴加稀硝酸,再滴加BaCl2溶液,也产生白色沉淀,反应的化学方程是BaCl2+2 AgNO3=2 AgCl↓+Ba﹙NO3﹚2【实验结论】向某溶液中先滴加足量稀硝酸,再滴加BaCl2溶液,若产生白色沉淀,原溶液中不一定含有SO42-。【拓展实验】向Na2SO4溶液中先滴加足量稀硝酸,再滴加BaCl2溶液,也产生白色沉淀。【查阅资料】①硝酸具有强氧化性②含有SO32-的盐统称为亚硫酸盐,亚硫酸盐都能与盐酸反应生成SO2气体。【交流反思】①向某一种钠盐的溶液中先滴加足量稀硝酸,再滴加BaCl2溶液,产生白色沉淀。原溶液中阴离子可能是SO42-,还可能是SO32- 。②下列实验方案中,能证明溶液里含有SO42-的是B.取样,先滴加稀盐酸,无明显现象,再滴加BaCl2溶液,产生白色沉淀。
Fe3O4②将反应后的黑色固体用磁铁检验,能被吸引。【实验结论】能被磁铁吸引的物质不一定是铁单质。话题2:含有Ba2+的盐一定有毒吗?【社会调查】在医院检查肠胃疾病时,病人需服用“钡餐”(主要成分为BaSO4)。【调查结论】“含有Ba2+的盐一定有毒”这句话是假的。【交流反思】若误服碳酸钡(BaCO3),胃酸的主要成分HCl会与之反应,形成可溶性钡盐,使人体内蛋白质变性而中毒,此时可服用硫酸镁解毒。话题3:向某溶液中先滴加足量稀硝酸,再滴加BaCl2溶液,产生白色沉淀,原溶液中一定含有SO42--吗?【实验回顾】向AgNO3溶液中先滴加稀硝酸,再滴加BaCl2溶液,也产生白色沉淀,反应的化学方程是BaCl2+2 AgNO3=2 AgCl↓+Ba﹙NO3﹚2【实验结论】向某溶液中先滴加足量稀硝酸,再滴加BaCl2溶液,若产生白色沉淀,原溶液中不一定含有SO42-。【拓展实验】向Na2SO4溶液中先滴加足量稀硝酸,再滴加BaCl2溶液,也产生白色沉淀。【查阅资料】①硝酸具有强氧化性②含有SO32-的盐统称为亚硫酸盐,亚硫酸盐都能与盐酸反应生成SO2气体。【交流反思】①向某一种钠盐的溶液中先滴加足量稀硝酸,再滴加BaCl2溶液,产生白色沉淀。原溶液中阴离子可能是SO42-,还可能是SO32- 。②下列实验方案中,能证明溶液里含有SO42-的是B.取样,先滴加稀盐酸,无明显现象,再滴加BaCl2溶液,产生白色沉淀。
考点∶考查实验探究的基本思路和方法。


科目:初中化学 来源: 题型:
【题目】阅读材料,回答问题.
材料:2000年悉尼奥运会,生物学家邓肯在4米深的水下手擎火炬潜泳3分钟,利用镁在氧气中燃烧,创造了“水火交融”的奇观,实现了火炬的水下传递(如图).
(1)物质燃烧的三个条件是:① ;② ;③达到燃烧所需的最低温度.
(2)分析火炬在水中燃烧的情况,请回答:
①火炬中镁在氧气中燃烧的化学方程式为
②水中火炬能保持燃烧所需的最低温度的原因是

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用量筒量取溶液,仰视凹液面最低处保持水平,读数为15毫升;倒出部分液体后,俯视凹液面的最低处,读数为9毫升。则该学生实际倒出的溶液体积
A.小于6毫升 B.大于6毫升 C.等于6毫升 D.无法确定范围
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们知道铁的化学性质比较活泼,能与氧气、酸、CuSO4溶液等多种物质发生化学反应。化学兴趣小组在课外资料中发现,铁和Fe2O3竟然也能发生化学反应。
【提出问题】
铁和Fe2O3反应的产物是什么?
【查阅资料】
①FeO、Fe2O3、Fe3O4中,Fe2O3是红棕色,其余是黑色;FeO在空气中会很快被氧化成Fe2O3;Fe3O4有磁性。②二氧化碳可用作该反应的保护气。③铁的氧化物都能与酸溶液反应。
【猜想与假设】
根据质量守恒定律,请你猜想铁和Fe2O3反应的产物:
①有FeO;②只有Fe3O4;③ 。
【进行实验】
(1)按下图装好药品(铁粉过量),连好仪器(装入药品前已检查装里的气密性)。
(2)轻推注射器活塞通入二氧化碳,估计玻璃管里空气 ,停止通入二氧化碳。
(3)点燃酒精喷灯加热药品,等到固体粉末全部变黑,再熄灭酒精喷灯。
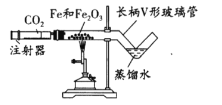
(4)当长柄V形玻璃管冷却至室温时,检验黑色粉末成分。检验过程如下(请填写表格中的空白):

【探究结论】
铁和Fe2O3能发生化合反应,有关的化学方程式是 。
【反思评价】
(1)实验结束,微热V形管中的液体,发生反应的化学方程式是 。
(2)本实验中的保护气,既能用二氧化碳气体,也能用 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组的同学用如图装置进行以下三个实验。
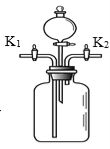
(1)若广口瓶中盛有MnO2,分液漏斗中盛有H2O2溶液。关闭K1,打开K2和分液漏斗的活塞,注入H2O2溶液后,关闭分液漏斗的活塞。广口瓶内发生反应的化学方程式是 ,检验生成气体的方法是 。
(2)若广口瓶中收集满CO2气体,分液漏斗中盛有NaOH溶液,右侧导气管伸入盛有水的烧杯中。打开分液漏斗的活塞,注入NaOH溶液后,关闭分液漏斗的活塞,一段时间后,打开K2,观察到的实验现象是 ,发生反应的化学方程式是 。
(3)【资料】CO2通入澄清石灰水中,石灰水变浑浊;继续通入CO2,变浑浊的石灰水又会逐渐变澄清。若广口瓶中盛有澄清石灰水,右侧导气管伸入盛有澄清石灰水的烧杯中。打开K1和K2,从K1处通入CO2。欲证明CO2不能被石灰水完全吸收,能观察到的实验现象是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定氯化钠和碳酸钠固体混合物中氯化钠的质量分数,有以下两个实验方案:

(1)【方案1】
请问:①操作II的名称是
②X的化学式为 (写一种)
(2)【方案2】 通过测定样品和足量硫酸溶液反应产生气体的质量来计算样品中氯化钠的质量分数。
①若测得各物质的质量(g):样品质量为m1,所用硫酸溶液质量为m2,完全反应后混合溶液质量为m3,则生成气体的质量为___________ g。(用m1、m2、m3表示)
②请你再设计一种测定生成气体质量的方法,并注明需要测定哪些数据?
【拓展提高】有人提出还有第三种方案:可用AgNO3溶液作为试剂,通过称量沉淀质量来确定氯化钠的质量?你认为是否可行,为什么?(2分 )
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。
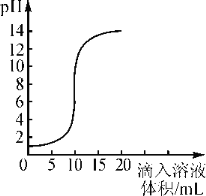
(1)氢氧化钠和盐酸恰好完全反应时,溶液的pH 7(选填“大于”、“小于”或“等于”);
(2)根据曲线判断,该反应是将 (选填“氢氧化钠溶液”或“盐酸”)滴入另一种溶液中,理由是 ;
(3)当滴入溶液的体积为5mL时,所得溶液中溶质的化学式为 ;
(4)欲中和20g溶质的质量分数为10%的氢氧化钠溶液,需溶质质量分数为x18.25%的稀盐酸 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com