
【题目】如图中甲、乙分别表示两种固体物质(不含结晶水)的溶解度曲线,试根据图中曲线判断下列说法正确的是( )
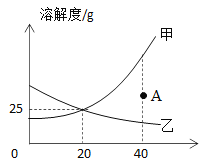
A.图中A点表示甲、乙两种物质在40℃时均达到饱和
B.甲、乙两种饱和溶液,当温度从40℃降至20℃时,一定析出相同质量的晶体
C.将40℃等质量的甲、乙两种饱和溶液降温至20℃后,剩余溶液中的溶剂的质量关系为甲小于乙
D.0℃时,甲、乙具有相同的溶解度
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:初中化学 来源: 题型:
【题目】将一定质量的NaCl和Na2SO4固体混合物放入烧杯后,加入一定质量分数的BaCl2溶液208g,恰好完全反应,过滤,得到23.3g沉淀。经测定滤液中含氯元素的质量为21.3g(不考虑过滤过程中物质质量的损失)。计算:
(1)所加BaCl2溶液的溶质质量分数。
(2)原固体混合物中Na2SO4的质量。
(3)求反应后所得溶液的溶质的质量分数(计算结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上可利用黄铁矿(主要成分是Fe2S)煅烧的产物冶炼铁和生产硫酸,其反应方程如下:
① ②
②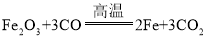 ③
③ ④
④![]()
下列说法不正确的是( )
A.反应①②③均有元素化合价发生变化
B.反应①②不属于四种基本反应类型中的任何一种,反应③④属于化合反应
C.将100g蒸馏水加入100g98%的浓硫酸中,可配制200g质量分数为49%的稀硫酸
D.将5gSO3溶于95g水形成溶液,其溶液中溶质的质量分数大于5%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值都发生了变化。某氧化镍样品组成为Ni0.97O,则该晶体中Ni3+与Ni2+的离子数之比为_____。
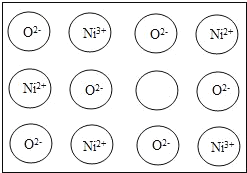
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)向含有 NaOH 和 Ca(OH)2 的混合溶液中缓缓通入 CO2直到过量。其现象为:开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:
①_____________ ②_________
③![]() ④_________
④_________
(2)高氯酸(HClO4)是最强酸。现有一种不常见的氯的化合物叫做高氯酸氯,其分子中氯的质量分数为 0.526,且每个分子中含有 4 个氧原子。
①高氯酸氯的化学式为___________,物质类别可归为 __________。
②高氯酸氯在室温下即发生分解,形成 Cl2、O2和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:___________。
(3)医药上可用石膏来固定骨折部位。石膏有熟石膏(CaSO4·![]() H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,固定骨折的石膏是__________________。(填化学式)。固定时发生反应的化学方程式__________________。
H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,固定骨折的石膏是__________________。(填化学式)。固定时发生反应的化学方程式__________________。
(4))CO与PdCl2溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测 CO 对环境的污染情况,此反应的化学方程式为:________,反应中中可能看到的现象是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】今年春天南方出现了H7N9禽流感,从香料八角中提取的莽草酸(C7H10O5)是合成治疗禽流感药物-达菲的原料。现有17.4g的莽草酸与一定量的氧气在点燃的条件下生成17.6g的:二氧化碳、9g的水和xg的CO。求x的值为_____,参加反应的氧气和莽草酸中的氧元素的质量比为_____,该反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)某同学在学完“碳和碳的氧化物”单元后,对CO2的用途、制取等进行了简要总结,请你帮助他填写完成相关内容:
①二氧化碳在生产、生活中具有广泛用途,如可用作______、___、工业原料等。
②已知生成CO2的反应有多种,请用化学方程式表示出其中的4种,要求这4个反应分属不同的基本反应类型:
I____________,Ⅱ______________,
III_____________,IV______________。
(2)海水是一种重要的自然资源(海水中含NaCl 、MgCl2等物质) ,被誉为“国防金属”的镁主要是从海水中提取的,下面是从海水中提取金属镁的简单流程。
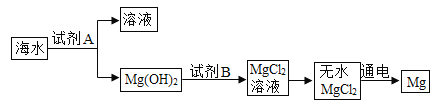
①从海水中获得淡水,常用的方法是____________。
②从海水中获得粗盐,可将海水进行__________________。
③试剂A最好选用____________________。
④试剂B与Mg( OH)2发生反应的化学方程式为________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】仔细阅读某试剂瓶上的标签,并回答下列有关问题:
过氧化氢溶液
[含量]过氧化氢的质量分数为30%
[密度]1.1g/cm3
[性状]无色透明液体;本身不能燃烧,但能与可燃物反应放出大量热量和氧气而引起着火爆炸;过氧化氢在pH为3.5-4.5时较稳定;遇光、热易分解。
[用途]………。
[贮藏]………。。
(1)过氧化氢在_____填(“酸性”、“碱性”或“中性”)溶液中较稳定。
(2)贮藏该过氧化氢溶液时应注意:①避光低温保存;②_____。
(3)若配制100mL3.3%(密度近似为1g/cm3)的过氧化氢溶液,则需要该溶液_____mL。
(4)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示。
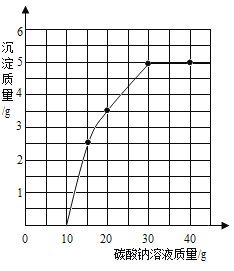
回答下列问题:
①开始加入碳酸钠溶液至10g时,还没有沉淀的原因是_____。
②计算原滤液中氯化钙的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是人类宝贵的自然资源。
(1)判断生活用水是硬水还是软水,可加入______________进行检验。
(2)下列净化水的单一操作中,相对净化程度较高的是_______(填字母)。
A 静置沉淀
B 吸附沉淀
C 蒸馏
D 过滤
(3)下图是甲、乙、丙三种固体物质的溶解度曲线,回答问题:
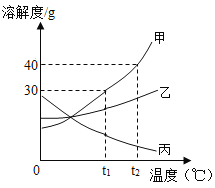
①t1℃时,甲、乙、丙三种物质溶解度 由大到小的顺序是______________。
②t2℃时,将 45g 甲加入到 50g 水中,充分溶解,所得溶液的质量为___________g。
③要使t1℃时,接近饱和的乙溶液变成该温度下的饱和溶液,可采用的方法是_________(写一种即可)。
④将t2℃时丙物质的饱和溶液降温到t1℃,此时该溶液的溶质质量分数___________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com