
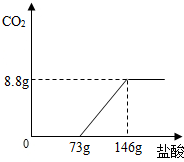
 (2008?随州)将稀盐酸逐滴加人到碳酸钠溶液中,先发生反应:Na2CO3+HCI═NaHCO3+NaCl,再发生反应:NaHCO3+HCl═NaCl+CO2↑+H2O.现取22g含有少量氯化钠的纯碱样品于烧杯中,加适量水将其溶解,然后逐滴加入适量稀盐酸,并不断振荡.测得滴加盐酸量与生成二氧化碳质量的关系如图所示.
(2008?随州)将稀盐酸逐滴加人到碳酸钠溶液中,先发生反应:Na2CO3+HCI═NaHCO3+NaCl,再发生反应:NaHCO3+HCl═NaCl+CO2↑+H2O.现取22g含有少量氯化钠的纯碱样品于烧杯中,加适量水将其溶解,然后逐滴加入适量稀盐酸,并不断振荡.测得滴加盐酸量与生成二氧化碳质量的关系如图所示.| 36.5 |
| 44 |
| x |
| 8.8g |
| 7.3g |
| 73g |
| 106 |
| 36.5 |
| y |
| 73g×10% |


科目:初中化学 来源: 题型:
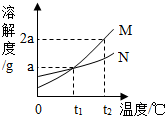 (2008?随州)如图所示是M、N两种物质的溶解度曲线,在t2℃时往盛有50g水的烧杯中先后加入a g M和a g N(两物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降到t1℃.下列说法错误的是( )
(2008?随州)如图所示是M、N两种物质的溶解度曲线,在t2℃时往盛有50g水的烧杯中先后加入a g M和a g N(两物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降到t1℃.下列说法错误的是( )查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
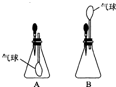 (2008?随州)小刚设计如图A、B所示装置进行下列趣味实验:
(2008?随州)小刚设计如图A、B所示装置进行下列趣味实验:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
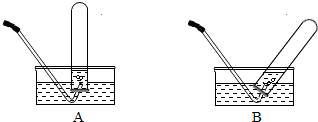 (2008?随州)马坪中学化学兴趣小组对“双氧水溶液与二氧化锰制氧气“进行了下列实验与探究:
(2008?随州)马坪中学化学兴趣小组对“双氧水溶液与二氧化锰制氧气“进行了下列实验与探究:| 条件 时间(min) 催化剂 |
60℃时,20%H202 | 40℃时,20%H202 | 20℃时,10%H202 | 20℃时,5%H202 |
| 不加催化剂 | ||||
| 加等量MnO2 | 0.3 | 0.5 | 1.O | 1.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com