现有氯化钾和盐A组成的固体混合物,其中A的质量分数为69%.取10g该固体样品加入50g质量分数为7.3%的盐酸,恰好完全反应得到无色溶液.反应的化学方程式为:A+2HCl=2KCl+H2O+B↑.
请回答下列问题:
(1)在A物质中阳离子与阴离子的个数比为______;
(2)计算A的相对分子质量;
(3)计算反应后溶液中氯化钾的质量分数(计算结果保留一位小数).
【答案】
分析:(1)根据质量守恒定律的实质可以求得A的化学式;
(2)相对分子质量是各元素的相对原子质量的总和
(3)根据化学方程式及A的质量可以求算出氯化钾的质量,然后结合质量分数的计算公式求算出反应的氯化钾溶液的质量分数.
解答:解:(1)根据盐A能与酸反应生成气体可确定盐A为碳酸盐;根据质量守恒定律反应后生成氯化钾;所以可以判断A的化学式为:K
2CO
3;在碳酸钾中阳离子钾离子与阴离子碳酸根离子的个数比为2:1故答案为:2:1
(2)相对分子质量是各元素的相对原子质量的总和,故碳酸钾的相对分子质量为:39×2+12+16×3═138
故答案为:138
(3)根据题给的条件可以知道碳酸钾的质量为:10g×69%=6.9g;
设反应生成的二氧化碳的质量为x,生成氯化钾的质量为y,则:
K
2CO
3+2HCl═2KCl+H
2O+CO
2↑
138 149 44
6.9g y x
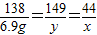
解得:x=2.2g
y=7.45g
所以反应后氯化钾的质量分数为:
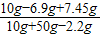
×100%=18.3%;
答:反应后溶液中氯化钾的质量分数为18.3%.
点评:掌握化学方程式的计算格式和规范性,注意反应后的溶液和溶质的质量的计算.

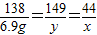
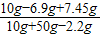 ×100%=18.3%;
×100%=18.3%;

 综合自测系列答案
综合自测系列答案