
【题目】碳酸镁水合物是制备镁产品的中间体。
【制取MgCO3·3H2O】工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO3·3H2O的方法如下: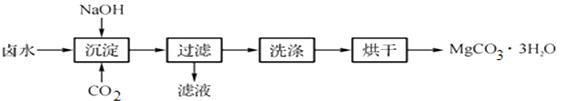
图1 获取MgCO3·3H2O的工艺流程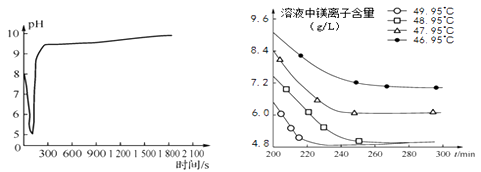
图2沉淀过程的pH变化 图3不同温度下溶液中镁离子含量随时间的变化
(1)沉淀过程的化学方程式为:
MgCl2+CO2+2NaOH+2H2O =MgCO3·3H2O↓+2
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为 (填字母)。
a. 向卤水中滴加NaOH溶液,同时通入CO2
b. 向NaOH溶液中滴加卤水,同时通入CO2
c. 向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d. 向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如表所示。
不同反应温度下的水合碳酸镁
温度(℃) | 产物 |
46.95 | MgCO3·3H2O |
47.95 | MgCO3·3H2O |
48.95 | MgCO3·3H2O |
49.95 | Mg5(OH)2(CO3)4·4H2O |
则沉淀过程选择的温度为 , 理由是。
(4)【测定MgCO3·3H2O的纯度】
利用下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO3·3H2O的纯度。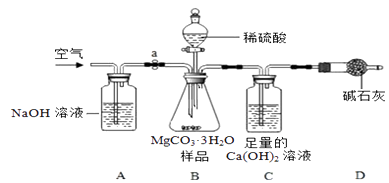
依据实验过程回答下列问题:
实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有。
(5)C中反应生成CaCO3的化学方程式为;D中碱石灰的作用为。
(6)下列各项措施中,不能提高测定准确度的是(填标号)。
a.在加入硫酸之前,应排净装置内的CO2气体
b.为了缩短实验时间,快速滴加硫酸
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在C装置左侧导管末端增添多孔球泡
(7)实验中准确称取15.0 g样品三份,进行三次测定,测得中生成CaCO3沉淀的平均质量为10.0 g。请计算样品中MgCO3·3H2O的纯度(写出计算过程)。
(8)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有。
(9)若获取MgCO3·3H2O的样品中含有少量Mg5(OH)2(CO3)4·4H2O,则产品中镁元素的质量分数(填“偏大”“不变”或“偏小”,下同),样品中MgCO3·3H2O的纯度。
【答案】
(1)NaCl
(2)c
(3)48.95℃,此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀
(4)把生成的CO2全部排入C中,使之完全被Ca(OH)2溶液吸收
(5)Ca(OH)2+CO2=CaCO3↓+H2O,防止空气中的CO2进入C干扰实验
(6)bc
(7)解:MgCO3·3H2O+ H2SO4= MgSO4+ CO2↑+4H2O;CO2 + Ca(OH)2 = CaCO3↓+ H2O;可得关系式为MgCO3·3H2O~ CO2~ CaCO3↓,设样品中MgCO3·3H2O的质量为x,
MgCO3·3H2O~ | CaCO3↓ |
138 | 100 |
x | 10.0g |
138/x=100/10.0g x=13.8g 样品中MgCO3·3H2O的纯度 13.8g÷15g×100%=92.0%
(8)因BaCO3的相对分子质量比CaCO3大,等质量的MgCO3·3H2O生成的BaCO3质量远大于CaCO3,实验时相对误差小
(9)偏大,偏大
【解析】(1). 据质量守恒定律反应前后原子的种类、个数不变,可得方程式为MgCl2+CO2+2NaOH+2H2O =MgCO3·3H2O↓+2NaCl (2). 由图可知,沉淀过程的pH随时间的变化是先变小至小于7,后变大至大于7,所以操作是向卤水中通入CO2至饱和,由于生成碳酸,溶液显酸性,pH小于7,然后滴加NaOH溶液,同时继续通入CO2,生成碳酸钠,溶液呈碱性。(3). 沉淀过程选择的温度为48.95℃,理由是:此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀(4). 实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2全部排入C中,使之完全被Ca(OH)2溶液吸收 ,否则装置内剩余二氧化碳不被吸收,导致测定结果偏小, (5). 石灰水的溶质氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O. D中碱石灰的作用为防止空气中的CO2进入C干扰实验,使测定结果偏大。 (6). 快速滴加硫酸,使生成二氧化碳的速率太快,不能被充分吸收;在A~B之间增添盛有浓硫酸的洗气装置不能提高测定的准确性,因为氢氧化钙不吸收水。(8). 因BaCO3的相对分子质量比CaCO3大,等质量的MgCO3·3H2O生成的BaCO3质量远大于CaCO3,实验时相对误差小 (9). ![]() ,若获取MgCO3·3H2O的样品中含有少量Mg5(OH)2(CO3)4·4H2O,则产品中镁元素的质量分数偏大,因为MgCO3·3H2O中镁元素的质量分数=24÷138×100%;Mg5(OH)2(CO3)4·4H2O镁元素的质量分数=(24×5)÷458×100%;同质量的Mg5(OH)2(CO3)4·4H2O比MgCO3·3H2O生成的碳酸钙沉淀多,,所以计算的纯度偏大.
,若获取MgCO3·3H2O的样品中含有少量Mg5(OH)2(CO3)4·4H2O,则产品中镁元素的质量分数偏大,因为MgCO3·3H2O中镁元素的质量分数=24÷138×100%;Mg5(OH)2(CO3)4·4H2O镁元素的质量分数=(24×5)÷458×100%;同质量的Mg5(OH)2(CO3)4·4H2O比MgCO3·3H2O生成的碳酸钙沉淀多,,所以计算的纯度偏大.
【考点精析】认真审题,首先需要了解书写化学方程式、文字表达式、电离方程式(注意:a、配平 b、条件 c、箭号),还要掌握根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比)的相关知识才是答题的关键.


科目:初中化学 来源: 题型:
【题目】化学变化为人类带来多种新物质和能量,充分利用这些变化,利用化学知识自如的控制化学变化,才能真正让化学服务于人类社会。
(1)“火立熄”灭火球是一种新型灭火装置,它接触到火焰3~5秒后炸开,将球体内的灭火干粉释放,覆盖在可燃物的上,同时释放不可燃气体,使火焰熄灭。其中的灭火材料是纳米级ABC干粉,主要成分是磷酸二氢铵(NH4H2PO4)。磷酸二氢铵在受热时,能够生成氨气、水、五氧化二磷,同时吸收大量的热。

①写出磷酸二氢铵受热反应的化学方程式__________________________________________;
②该灭火球灭火过程中蕴含的原理是(写出一条即可)___________________________;
③磷酸二氢铵还是一种常用的化肥,下列说法不正确的是_________。
A.磷酸二氢铵是一种复合肥 B.使用该化肥时应避免与碱性物质混用
C.该化肥中氢、氧元素质量比为3∶2 D.运输、储存该化肥时应避免日晒雨淋
(2)氯气和氧气都是活泼的非金属单质,在一定条件下它们都能跟甲烷发生反应。已知O2和CH4充分反应后的生成物是CO2和H2O,据此可推知,Cl2和CH4充分反应的化学方程式为______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】最新研究发现,水能凝结成13种不同类型的结晶体。除普通冰外,还有在﹣30℃时才凝固的低温冰,在180℃时状态依然不变的热冰,比水的密度大的重冰等。下列说法正确的是( )
A.重冰的化学性质与普通水相同
B.低温冰中水分子不再运动
C.低温冰是一种不同于水的新物质
D.重冰中分子间间隔比普通水的间隔大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是某化学反应的微观模型,“○”“●”分别表示不同元素的原子,下列对图示模型理解正确的是( )

A.反应过程中有三种单质分子
B.整个变化过程中 没有物理变化
C.这是两种单质反应生成一种单质和一种化合物的反应
D.参加反应的“![]() ”和“
”和“![]() ”分子的个数比是3:1
”分子的个数比是3:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请结合如下图实验常用装置,回答有关问题.
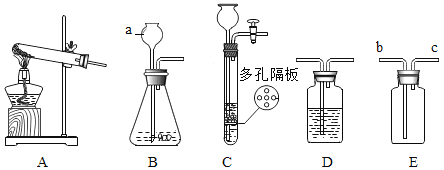
(1)写出图中a仪器的名称:________________。
(2)若用高锰酸钾制取氧气,应选用的发生装置是____(填装置序号),在加入药品前,应首先检查___,在正确选择的发生装置中还存在第一个缺陷,改进的方法是___,反应的化学方程式是__。
(3)若要制取二氧化碳,反应装置可选取_________。
(4)甲烷是一种密度比空气小,难溶于水的气体,实验室常用无水醋酸钠固体和碱石灰固体共热制取甲烷,应选择的发生装置是___(填装置序号),若选用E装置用于排空气法收集 甲烷,甲烷应从_____(填“b”或“C”)端通入,若选用D装置用于排水法收集甲烷,瓶中先装满水,甲烷应从_______(填“左”或“右”)端通入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】近日网路传言用不锈钢水壶烧水会导致锰中毒。专家实验证明,使用正规厂家生产的不锈钢水壶烧开水并无明显风险隐患,但不建议用于酸性和碱性环境中。
查阅资料:锰的化学性质与铁相似,它的活动性比铁强,MnSO4 溶液为浅红色。
(1)写出Mn 与CuSO4 溶液反应的化学方程式(产物中锰的化合价为+2 价) 。
(2)MnO2 常用作H2O2 制取O2 的催化剂,工业上用菱锰矿(主要成分MnCO3)制取MnO2,过程如下:
步骤1:将22t 菱锰矿粉碎;
步骤2:往粉碎后的菱锰矿中加入H2SO4 溶解MnCO3,写出化学方程式
,反应的现象是 ;
步骤3:把生成的MnSO4 再与NH4HCO3 反应后得到11.5t MnCO3,MnCO3 再经过煅烧、
氧化转变为MnO2,涉及到的化学反应如下:
![]()
计算理论上能制得MnO2 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组同学在清理实验室时发现一瓶浓盐酸,标签如下。

报据标签计算。
(1)HCl中氢元素和氧元素的质量比为 (结国用最简整数比表示)。
(2)这瓶盐酸溶液的质量为 g。
(3)现要配制3800g溶质质量分数为10%的稀盐酸,需要溶质质量分数为38%的浓盐酸的质量为 g,需要这种浓盐酸 瓶。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com