
���ձ��м����Ȼ��ƺ�̼�����ƵĹ�������10.0g���ټ���68.9gϡ����ǡ����ȫ��Ӧ����Ӧ�����þ�����������ձ���ͬҩƷ����������m���뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ���ձ���ͬҩƷ����ʼ������Ϊ165.0g����Ӧ�ķ���ʽΪ��NaHCO3+HCl�TNaCl+H2O+CO2���Իش��������⣺
��1����ȫ��Ӧʱ����������̼������Ϊ�� ��g
��2��ԭ��������Ȼ��Ƶ�������
��3����Ӧ�������Ȼ�����Һ����������������
��1��4.4����2����ԭ��������Ȼ��Ƶ�����Ϊ1.6g��3���𣺷�Ӧ�������Ȼ�����Һ����������������10%��
������������� ��1�����������غ㶨�ɣ���Ӧ���ɶ�����̼���������=165.0g��160.6g="4.4" g
��2����ԭ�������̼�����Ƶ�����Ϊx�������Ȼ��Ƶ�����Ϊy
NaHCO3+HCl=NaCl+H2O+CO2��
84 58.5 44
x y 4.4g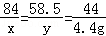
��֮�ã�x=8.4g��y=5.85g
����ԭ��������Ȼ��Ƶ�����Ϊ10.0g��8.4g=1.6g
��2����Ӧ��������Һ����="68.9" g+10.0g��4.4g=74.5g
��Ӧ��������Һ��������������=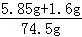 ��100%=10%
��100%=10%
�𣺷�Ӧ��������Һ��������������10%��
���㣺���ݻ�ѧ��Ӧ����ʽ�ļ��㣻�й��������������ļ��㣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
����ͨ�����ǵĻ���û�ѧ��Ӧ2N2H4+N2O4 3X+4H2OΪ������Դ��
3X+4H2OΪ������Դ��
��1��������ѧ��Ӧ��X�Ļ�ѧʽ����_________����
��2�������320g N2H4��ȫȼ��ʱ����N2O4��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��ѧС��ͬѧ���ⶨͭп�Ͻ���ͭԪ�ص�����������
��1��������ȡ10 g�Ͻ��ĩ����������ϡ������ռ���0.1 g����������Ͻ���ͭԪ�ص���������Ϊ67.5%����ʦָ����ⶨ�����ȷ��ԭ���� ��
��2���ҷ�����ȡ10 g�Ͻ��ĩ��������������ͭ��Һ����ַ�Ӧ���ˣ�ϴ�ӣ���ɣ���ù�������Ϊ9.9 g������Ͻ���ͭԪ�ص�������������д���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
̼��̼���������������г��������ʣ�Ҳ�dz��л�ѧѧϰ����Ҫ���ݣ�
��1����ͼ �ǣ�����˵������ȷ������ ����
�ǣ�����˵������ȷ������ ����
| A����ԭ�ӵ�������Ϊ8 |
| B����ԭ���ڻ�ѧ��Ӧ����ʧȥ���� |
| C�����ǵؿ��к�������Ԫ�� |
| D����ԭ���������ӵĻ�ѧ���ʲ�ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
ij��ҵ̼������Ʒ�л��������Ȼ��ƣ�Ϊ�˲ⶨ��Ʒ�Ĵ��ȣ���12��0g��Ʒ�еμ�ϡ������ǡ����ȫ��Ӧ����������̼���岻�ٷų���ȥ����Һ�е�ˮ�֣����յõ�13��1g�Ȼ��ƹ��塣�Լ��㹤ҵ̼������Ʒ��Na2CO3�������������������ȷ��0��1%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��Ҫ����������4%������100 t����Ҫ��������60%�ij�����ʯ�������Ƕ��٣���Ҫ��д��������̣�����������С�����1λ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��16g�������ʵ�п��Ͷ�뵽ʢ������ϡ������ձ��У����ʸ�ϡ�����Ӧ������ü���п��ǰ�ձ���ϡ�����������Ϊ200g����Ӧֹͣ���ձ����ձ���ʣ�����������Ϊ215.6g����
��1����Ӧ�������������������� ��
��2����16g�����ʵ�п���н���п�������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�����Ƽ�ĺ��ķ�Ӧԭ�����£�NH3+CO2+NaCl+H2O�TNH4Cl+NaHCO3
ij�¶��£������ʵ���������Ϊ20%���Ȼ�����Һ47.25g��ͨ��һ����������NH3���Ͷ�����̼����ַ�Ӧ����Һ��������̼�����ƾ�����ˣ����º�ɣ�����������Ϊ4.4g��������Ҫͨ�백��������������֪�����¶���̼�����Ʊ�����Һ�У�̼��������ˮ��������Ϊ1��9������Һ���������������ʣ������������ֵ����Ӱ�죩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
���ȸ�������ֽܷ��������ijͬѧ���Ʊ�16g���������������һ�£�������Ҫ���ȷֽ���ٿ˸�����أ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com