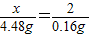某+2价金属4.48克与足量稀硫反应,生成0.16克氢气,则该金属的相对原子质量是( )
A.40
B.56
C.65
D.24
【答案】
分析:根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.在本题中假设金属为R,某+2价金属R与硫酸反应生成RSO
4和H
2.可以根据R和氢气的质量,求该金属的相对原子质量.注意事项有:设未知数不带单位,计算过程中要带单位,结果要带单位.
解答:解:设该金属的相对原子质量是x,
R+H
2SO
4 =RSO
4 +H
2↑
x 2
4.48g 0.16g
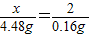
x=56
A、40<56,故选项错误;
B、x=56,故选项正确;
C、65>56,故选项错误;
D、24<56,故选项错误;
故选B.
点评:本考点考查了根据化学方程式的计算,本题是根据实际质量,求金属的相对原子质量.是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,还要记牢“遇到差值要想气体”.本考点主要出现在选择题和计算题中.