
| 溶解度 |
| 100g+溶解度 |
| 溶解度 |
| 100g+溶解度 |
| 13.5g |
| 67.5g |
| 溶解度 |
| 100g+溶解度 |
| 溶质的质量 |
| 溶液的质量 |


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:初中化学 来源: 题型:
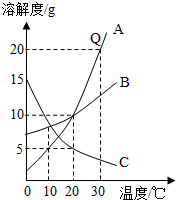 如图是A、B、C三种物质的溶解度曲线.
如图是A、B、C三种物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶 解/g 度 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| Ca(OH)2 | 0.187 | 0.178 | 0.165 | 0.153 | 0.141 | 0.129 | 0.116 | |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 温度 盐 溶解度 |
10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 温度/℃ | 10 | 20 | 30 | 40 |
| 溶解度/g | 31.0 | 34.0 | 37.0 | 40.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 KNO3和KCl在不同温度时的溶解度如下表所示.
KNO3和KCl在不同温度时的溶解度如下表所示.| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com