
分析 稀盐酸和氢氧化钠反应生成氯化钠和水,根据提供的数据可以进行相关方面的计算.
解答 解:(1)设氯化氢的质量为x,生成氯化钠质量为y,
氢氧化钠溶液中氢氧化钠质量为:100g×16%=16g,
NaOH+HCl═NaCl+H2O,
40 36.5 58.5
16g x y
$\frac{40}{16g}$=$\frac{36.5}{x}$=$\frac{58.5}{y}$,
x=14.6g,y=23.4g,
答:生成氯化钠的质量是23.4g.
(2)稀盐酸中溶质的质量分数为:$\frac{14.6g}{100g}$×100%=14.6%,
答:稀盐酸中溶质的质量分数为14.6%.
(3)所得溶液中溶质的质量分数为:$\frac{23.4g}{100g+100g}$×100%=11.7%,
答:所得溶液中溶质的质量分数为11.7%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


科目:初中化学 来源: 题型:解答题
| 组别 | 相同的铝片 | pH=3 的酸 | 反应片刻后添加的试剂(少量) | 添加试剂后的反应现象 |
| 1 | 1g铝片 | 5ml硝酸 | Na2SO4 | 无明显变化 |
| 2 | 1g铝片 | 5ml硝酸 | NaCl | 明显加快 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe+H2SO4=FeSO4+H2↑ | B. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | ||
| C. | 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | D. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
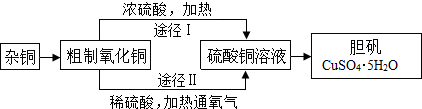
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com