
����Ŀ�� ��ѧʵ����ϣ���ʦΪÿ��ͬѧ�ֱ��ṩ��һƿ����������Һ����������1%��ϡ���ᣨ�ܶ�Ϊ1.1g/mL�����ⶨ�����ʵ���������������ͬѧ��ʵ����ͼ1��ʾ�����ձ��м���5g����������Һ�����뼸�η�̪��Һ���õι���������1%��ϡ���ᣬ�����Ͻ���, ��ҺpH�ı仯��ͼ2��ʾ��
( ��Ӧ�Ļ�ѧ����ʽΪNaOH + HCl === NaCl + H2O )
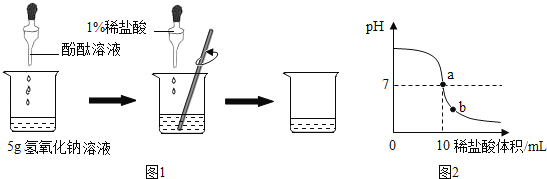
��ش𣺣�1����ͼ2��ʾ��a����Һ�д��ڵ���������__________�����ӷ��ű�ʾ��
��2��ǡ����ȫ��Ӧʱ������ϡ�������������__________ g��
��3����������������Һ�����ʵ���������������ȷ��0.1%��
���𰸡���1�� Na+ ��2�� 0.11 ��3��2.4%
��������
�����������1��a���ʾ���ǡ����ȫ��Ӧ����NaCl ��H2O������Һ�е�������ΪNa+
(2) ǡ����ȫ��Ӧʱ������ϡ��������Ϊ10ml������������=10ml��1.1g/ml��1%=0.11g
��3���⣺������������Һ�����ʵ�����Ϊx��
NaOH + HCl == NaCl + H2O
40 36.5
x 0.11g
![]()
![]() =
=![]() X=0.12 g
X=0.12 g
NaOH%=![]() ��100% =2.4��
��100% =2.4��
������������Һ�����ʵ���������Ϊ2.4��.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���âٿ����ڶ�����̼�۱�ˮ�����������ݺ��ע�����أ�KMnO4�����������ʵ������գ�
��1�����ڻ������� ��2�����ڴ��������
��3�����ڻ�������� ��4�����ڵ��ʵ���
��5��������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�����Ƶ�������ˮ��Ϊ�˼ӿ������ʣ�����ˮ�м�������������ǿ�䵼���ԣ�������93.6g��������Ϊ5%����������Һ��ͨ��һ��ʱ��������ϲ���3.2g���������㣺
��1�������ϲ���������������
��2��ͨ�����Һ�������Ƶ�����������
��3����ͬѧ��Ϊ������ʽ������ּ�����ͨ������Һ�м��������ƣ���Ҫʹ��Һ�����ʵ�����������Ϊ10%������Ҫ���������ƹ���������Ƕ��٣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڴ�����˵����ȷ����
A�������ڻ�ѧ��Ӧǰ�����������ʶ�����
B������ֻ�ܼӿ췴Ӧ����
C�������ܼӿ췴Ӧ����Ҳ�ܼ�����Ӧ����
D�����û�ж�������������������ؼ��Ȳ���ֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�CaO2����һ�ֶ���������ͨ����Ca(OH)2Ϊԭ���Ƶã��Ʊ��������£�
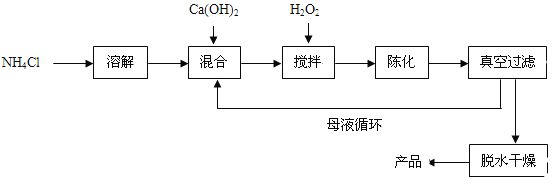
��1��ԭ����NH4Cl����Ԫ�صĻ��ϼ��� ��NH4Cl������ �ʣ���ʵ����ࣩ��
��2����������з�����Ӧ�Ļ�ѧ����ʽ��CaCl2 + H2O2 + 2NH3��H2O + 6H2O = CaO2��8H2O��+ 2 NH4Cl��
�Ʊ������г�ˮ���ѭ��ʹ�õ������� ���ѧʽ����
��3�� ��ҵ��Ҳ������ʯ�Һ�ˮ��˫��ˮ�������Ϸ�Ӧ��Ҳ������CaO28H2O����Ӧ�Ļ�ѧ����ʽ Ϊ �������ַ�����ò�Ʒ�к��������������ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͨ����ѧ��Ӧ��ô�������
��1������ȼ����Ȼ������Ҫ�ɷ��Ǽ��飬����ȫȼ�յĻ�ѧ����ʽΪ ��
��2�����������(N2H4)��ȼ�ϣ���������������ȼ�������е�����Ԫ�ص�������Ϊ ��
��3������ȼ�������л������ ��
A��CO B��H2 C��CH4 D��C2H5OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С���������ʴ��������ʵ�顣����ʱ����������Ʒ������������ֽ���ô�ͷ��̶��������ϣ�Ѹ��������װ����ͼ���۲쵽��Ͳ��ˮ�ص�������������ƿ���ݻ�150mL�������¶Ȼָ������£�����Ͳ��ˮ��߶Ȳ���ʱ��������¼��ʼ��������Ͳ�Ķ����Լ�����ʱ�䣬���±���
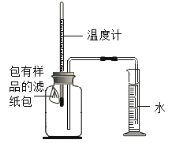
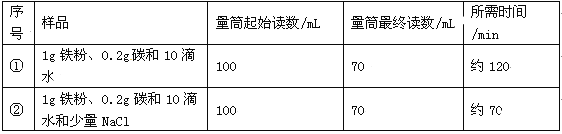
��1��ʵ��ٺ͢�˵��NaCl���� ����ӿ족������������ʴ�����ʡ�
��2��ʵ�鿪ʼ���ƿ���¶�����������˵��������ʴ������ (����ȡ������ȡ�)���̡�
��3������̽��̼������ʴ���ʵ�Ӱ�죬Ӧѡ���ҩƷ�� ��
��4����װ�û������ڲ��������������ĺ����������������ݼ���������������ļ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������������������Ϊ10%��NaCl��Һ��ʵ�����ʾ��ͼ��

��1������ͼ����ű�ʾ������Һ����ȷ����˳��Ϊ_____��
��2���������ò����������Ŀ���� ��
��3������NaClʱ����ƽƽ����״̬��ͼ��ʾ��������ʾ������ͼ������Ҫ��ȡˮ������� ��ˮ���ܶ�Ϊ1 g/mL����
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ�ӡ����ӡ����ӵ�˵���У��������
A��ԭ�Ӳ���ֱ�ӹ�������
B�����ӿ��Ա������ʵĻ�ѧ����
C��ԭ�ӵ�������Ҫ������ԭ�Ӻ���
D������ԭ��ʧȥ���ӻ��γ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com