
【题目】甲和乙两种物质的溶解度曲线如图所示。
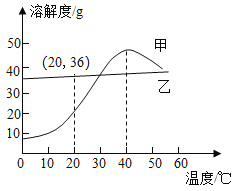
(1)请写出图像中(20,36)表达的含义_____________。
(2)在40℃时,若把甲的不饱和溶液变成饱和溶液,在保持溶质质量分数不变的情况下可采取的方法为________________、_________(两种方法)。
(3)在生产生活中,我们常常采取__________获得乙物质晶体。
(4)下列说法正确的是__________。
①甲的溶解度随温度的升高而增大
②40℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法
③20℃时,向125g溶质质量分数为20%的乙溶液中加入15g乙固体并振荡,有固体不溶解
④将相同质量的甲和乙的饱和溶液分别从40℃降温至10℃,甲析出晶体的质量多
【答案】乙在20℃时的溶解度为36 g 升温 降温 蒸发结晶 ②③④
【解析】
(1)根据溶解度曲线可知,图像中(20,36)表达的含义乙在20℃时的溶解度为36 g;
(2)在小于40℃时,甲的溶解度随温度的升高而降低,在大于40℃时,甲的溶解度随温度的升高而降低。在40℃时,若把甲的不饱和溶液变成饱和溶液,在保持溶质质量分数不变的情况下可采取的方法为升温、降低;
(3)乙的溶解度随温度的升高而升高,受温度影响不大,在生产生活中,我们常常采取蒸发结晶获得乙物质晶体;
(4)①在小于40℃时,甲的溶解度随温度的升高而降低,在大于40℃时,甲的溶解度随温度的升高而降低,故①错误;
②在小于40℃时,甲的溶解度随温度的升高而降低,在大于40℃时,甲的溶解度随温度的升高而降低,40℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法,故②正确;
③125g溶质质量分数为20%的乙溶液中乙的质量=125g×20%=25g,溶剂的质量=125g-25g=100g,乙在20℃时的溶解度为36 g,100g水中最多溶解36g,20℃时,向125g溶质质量分数为20%的乙溶液中加入15g乙固体并振荡,有固体不溶解,故③正确;
④小于40℃时,甲、乙的溶解度随温度的降低而降低,甲的溶解度受温度影响较乙大,将相同质量的甲和乙的饱和溶液分别从40℃降温至10℃,甲析出晶体的质量多,故正确。故选②③④。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:初中化学 来源: 题型:
【题目】学习化学后,我们可以用所学的化学知识回答生活中与化学相关的问题。
(1)目前部分农村的饮用水主要还是地下水。饮用遭到污染或硬度大的地下水不利于人体健康。
① 检验某地下水是硬水还是软水,可用的物质是_________。
② 测定地下水的酸碱度可用_________。(填标号)
A.紫色石蕊溶液 B.无色酚酞溶液 C.pH试纸
③ 自来水生产过程中,可用沉降、_________方法除去水中不溶性杂质,同时还必须进行消毒。X是一种新型的自来水消毒剂,工业上制取X 的化学方程式为:Cl2 + 2NaClO2 == 2NaCl + 2X,则X的化学式为________。
(2)现在,我们家里厨房做饭用的主要燃料为天然气,天然气的主要成分是_________(填化学式),其燃烧的化学方程式为____________,家用燃料经过了如下的更新过程
![]()
下列有关家用燃料更新的理由,正确的是_________________。
A.天然气是新能源,取之不尽用之不竭 B.气体燃料的利用率更高 C.减少煤燃烧过程中产生的污染物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)下图是利用海水提取粗盐的过程:
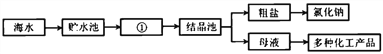
上图中①是_____池 (填“蒸发”或“冷却”)。
(2)粗盐中含有少量 CaCl2、MgCl2、Na2SO4 和泥沙,某同学将该粗盐样品进行提纯。
①将样品加适量水溶解,然后进行_____,除去泥沙等难溶性杂质,得到澄清溶液;
②向所得的澄清溶液中依次加入稍过量的 BaCl2 溶液、NaOH 溶液和_____溶液, 除去生成的沉淀后,再滴加稍过量的稀盐酸,得到较纯挣的 NaCl 溶液;
③蒸发溶液,得到较多氯化钠固体时停止加热,他注意到不能立即把_____直接放 在实验台上,以免烫坏实验台。
(3)另一同学用所得的氯化钠和蒸馏水配制溶质质量分数为 6%的氯化钠溶液。配制步骤:①称量和量取②溶解③计算④装入试剂瓶贴好标签。配制上述溶液的正确顺序是_______ (填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】回顾实验室制取![]() 的实验,我们可知:研究实验室制取气体的一般顺序:
的实验,我们可知:研究实验室制取气体的一般顺序:
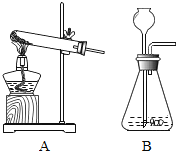
(1)首先研究生成该气体的化学反应原理;
(2)然后根据反应物的状态和反应的条件选择并安装实验仪器,而且一定要检查________;
(3)根据收集气体的________和________确定气体的收集方法;
(4)图中是制氧气的两套装置,按要求回答:
①加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为________;制得氧气后,剩余固体是氯化钾(易溶于水)和二氧化锰(难溶于水)的混合物,将它们分离后可回收使用.分离时,先将混合物放在烧杯中,加适量________并________;将所得的悬浊液进行________,可得到________;将滤液进行________,可得到________.
②实验室用过氧化氢和二氧化锰制氧气可选________(图A或B),原因________.
③某兴趣小组取![]() 克过氧化氢溶液在
克过氧化氢溶液在![]() 克二氧化锰的作用下反应,反应一段时间后测得容器中剩余物质的总质量为
克二氧化锰的作用下反应,反应一段时间后测得容器中剩余物质的总质量为![]() 克.试计算:
克.试计算:
(A)该实验中生成氧气的质量为________克,物质的量________摩尔.
(B)根据化学方程式列式计算参加反应的过氧化氢的物质的量____________.
④硫化氢![]() 是一种具有臭鸡蛋气味的气体,其密度比空气的密度大,且能溶于水形成氢硫酸.实验室通常用块状固体硫化亚铁
是一种具有臭鸡蛋气味的气体,其密度比空气的密度大,且能溶于水形成氢硫酸.实验室通常用块状固体硫化亚铁![]() 和稀硫酸
和稀硫酸![]() 混合,在常温下发生反应生成硫酸亚铁和硫化氢气体.试回答:
混合,在常温下发生反应生成硫酸亚铁和硫化氢气体.试回答:
(A)实验室制取硫化氢的化学反应方程式为:________.
(B)制取硫化氢气体的发生装置可以选用________(图A或B);
(C)收集硫化氢气体可用________法.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳在地壳中的含量不高,但它的化合物数量众多,而且分布极广。根据所学知识回答:

(1)图①为碳原子的结构示意图,碳原子最外层电子数为________,常温下碳的化学性质________,(填“活泼”或“不活泼”)。
(2)图②、③、④对应三种碳单质:图②单质的名称是________,图③单质的名称是________,图④单质的化学式是________。
(3)C为+4价,Cl为-1价,由C和Cl组成的化合物的化学式为________。
(4)实验室若选用图⑤装置制取二氧化碳,则需要改正的一点是________,请你写出用石灰石与稀盐酸反应制取二氧化碳的化学方程式________,将产生的二氧化碳气体通入澄清石灰水,反应的化学方程式是________。
(5)用制取的二氧化碳进行如下实验:
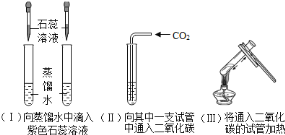
①实验(II)中溶液变________色。
②实脸(III)中加热之后溶液又变为________色,用化学方程式解释出现此现象的原因________。
(6)工业上高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取10t氧化钙,需要碳酸钙多少吨______?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】丁烯(C4H8)是一种重要的化工原料,下列有关说法正确的是
A.丁烯中C、H元素的质量比为1:2
B.丁烯中碳元素位于元素周期表第二周期
C.碳原子的结构示意图为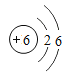
D.丁烯分子中含有4个碳元素和8个氢元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,用“W”型玻璃管进行微型实验。
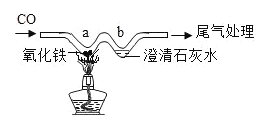
(1)描述a处的实验现象_____;
(2)写出b处发生反应的化学方程式_____。
(3)写出a处发生反应提供热量的化学反应方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验小组的同学研讨初中常见酸、碱、盐之间的反应关系时,做了如下实验,实验中的每一步均有明显现象,实验操作及部分现象如下图所示.
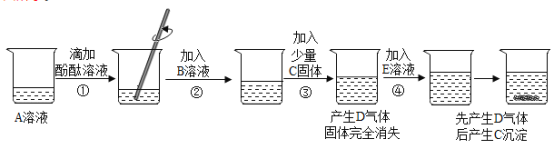
回答下列问题:
(1)A溶液一定呈_____性(填“酸”或“中”或“碱”).
(2)气体D的化学式为___________________.
(3)步骤②的实验现象为__________________________.
(4)E溶液中的溶质可能是_______________.
(5)B溶液的溶质由两种元素组成,④中产生气体的反应的化学方程式为______________________.
(6)实验后将盛有C固体烧杯中的上清液取出少量,继续加入E溶液,仍有C固体析出,已知A与E中的阳离子相同,则实验后所得溶液含有的溶质为______________________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图是甲、乙两种物质的溶解度曲线,请结合图回答问题:
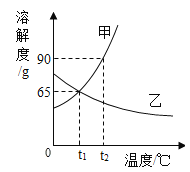
(1)_____℃时,甲、乙两种物质的溶解度相等。
(2)溶解度随温度升高而降低的物质是__________(填“甲”或“乙”)。
(3)可使甲物质从其饱和溶液中结晶析出的方法是_________。
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数______(填“大于”、“等于”或“小于”)乙溶液的溶质质量分数。
(5)小明同学用甲物质进行以下实验:
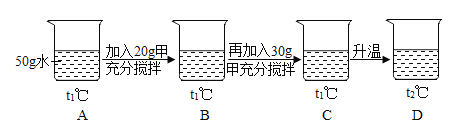
①实验过程中,B、C、D对应的溶液为不饱和溶液的是____________________。
②向B对应的溶液中再加入30g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com