解:(1)标号仪器分别是集气瓶和长颈漏斗;
(2)加热高锰酸钾制取氧气属于固体加热型,故选发生装置A;方程式是;2KMnO
4
K
2MnO
4+MnO
2+O
2↑;过氧化氢在二氧化锰的催化作用下生成水和氧气,方程式是:2H
2O
2
2H
2O+O
2↑;
(3)锌和稀硫酸反应生成硫酸锌和氢气,方程式是:Zn+H
2SO
4═ZnSO
4+H
2↑;
(4)装置C打开弹簧夹,固液混合生成气体,关闭弹簧夹,试管内压强增大,将液体压入长颈漏斗,固液分离,反应停止;
(5)Ⅰ、碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可,方程式为:CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O;
Ⅱ、对比甲同学实验①②可知,盐酸的质量分数越大,则反应速度越快;
Ⅲ、②这粉末状石头纸比③中团状石头纸反应快,说明反应物的接触面积越大,反应速率越快;
Ⅳ、乙同学的实验可通过称量锥形瓶及药品的质量随时间变化判断反应速率,或称量生成二氧化碳的质量;
(6)①根据装置特点,连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置2(I)不漏气,气密性良好;
②二氧化碳能溶于水,且可与水反应,图2(Ⅱ)装置中油层的作用是防止二氧化碳溶于水、与水反应,使测量结果更准确;
③反应停止后,上下移动量气管使反应前后油层上方气体压强和外界大气压相同,测量此时排出水的体积即为生成二氧化碳的体积;
(7)①第1份和第2份比较可以发现,当稀盐酸的质量增加时,气体的质量也在增加,说明第1份中碳酸钙没有完全反应,稀盐酸完全反应;
②第1份放出二氧化碳的质量0.88g,说明每加入10mL稀盐酸与碳酸钙完全反应,产生二氧化碳的质量为0.88g;第2份加入20mL盐酸,是第一份稀盐酸质量的2倍,产生二氧化碳的质量为1.76g,也是第一份产生气体质量的2倍;而第三份加入30mL盐酸,产生二氧化碳的质量为2.2g,小于第一份产生气体的质量的3倍(0.88g×3=2.56g),说明碳酸钙此时完全反应,稀盐酸有剩余,则第四份盐酸不反应.观察生成二氧化碳气体的记录,都保留小数点两位数字,故m的值为2.20;
③设参加反应的碳酸钙的质量为x.
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 44
x 2.20g
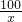
=
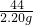
x=5g
石灰石中碳酸钙的质量分数为:
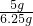
×100%=80%
答:石灰石中碳酸钙的质量分数为83.3%.
④要画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图,找出起点、最大值、折点、曲线的走势,画出图象即可,由②分析可知:每加入10mL稀盐酸与碳酸钙完全反应,产生二氧化碳的质量为0.88g;则生成2.2g二氧化碳,需要25mL稀盐酸,此时二者恰好反应,随着稀盐酸量的增多,二氧化碳的量也不再增加;故答案为:(1)集气瓶;长颈漏斗;
(2)A;2KMnO
4
K
2MnO
4+MnO
2+O
2↑;2H
2O
2
2H
2O+O
2↑;
(3)Zn+H
2SO
4═ZnSO
4+H
2↑;c;
(4)C;
(5)Ⅰ、CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O;Ⅱ、盐酸越浓(溶质的质量分数越大);Ⅲ、②③;快;Ⅳ、时间;锥形瓶及药品的质量或二氧化碳的质量;
(6)①良好;②防止二氧化碳溶于水、与水反应或隔绝二氧化碳与水;③B;
(7)①2.20; ②2.20; ③80%; ④图象如下:

分析:(1)依据常用仪器回答;
(2)依据高锰酸钾制取氧气的反应物状态和反应条件选择发生装置,依据高锰酸钾、过氧化氢制取氧气的反应原理书写方程式;
(3)依据实验室制取氢气的反应原理书写方程式,若将E装置中收集的氢气排出,应从长管进水;
(4)根据装置C的特点分析其优点;
(5)根据碳酸钙和盐酸反应原理书写方程式,并据实验现象、结论相互结合分析解答;
(6)根据检查装置气密性的方法、二氧化碳的溶解性及可与水反应的性质分析解答,并据装置特点分析;
(7)①第1份和第2份比较可以发现,当稀盐酸的质量增加时,气体的质量也在增加,说明第1份中碳酸钙没有完全反应,稀盐酸完全反应;
②根据表格中数据分析,当石灰石样品一定时,稀盐酸和产生二氧化碳的质量关系为10g:0.88g,据此进行分析判断;
③根据题意,6.25g石灰石样品与稀盐酸完全反应产生二氧化碳的质量为2.2g,据此可以计算出参加反应的碳酸钙的质量,进而可以计算出碳酸钙的质量分数;
④找出起点、最大值、折点、曲线的走势,画出图象即可.
点评:本题考查知识点多,思维跨度大,既考查了实验室制取氢气、氧气反应原理、装置选取,又考查学生对物质的性质、实验探究和分析能力,及对数据的分析应用能力、利用化学方程式的综合计算,合理使用数据、灵活运用化学方程式的计算,综合分析和解决实际问题是正确解答此类题的关键,有一定难度.




 K2MnO4+MnO2+O2↑;过氧化氢在二氧化锰的催化作用下生成水和氧气,方程式是:2H2O2
K2MnO4+MnO2+O2↑;过氧化氢在二氧化锰的催化作用下生成水和氧气,方程式是:2H2O2 2H2O+O2↑;
2H2O+O2↑;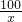 =
=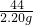
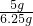 ×100%=80%
×100%=80% K2MnO4+MnO2+O2↑;2H2O2
K2MnO4+MnO2+O2↑;2H2O2 2H2O+O2↑;
2H2O+O2↑;


 28、水在实验室和日常生活中有着十分重要的作用.
28、水在实验室和日常生活中有着十分重要的作用.
 (1)水是重要的资源,水资源不足,将严重影响人类生存.请结合下表回答:
(1)水是重要的资源,水资源不足,将严重影响人类生存.请结合下表回答: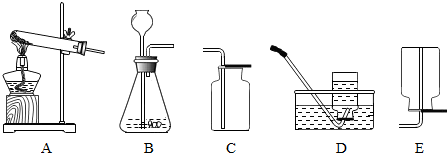
 、
、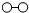 、
、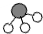 分别表示N2、H2、NH3.在催化剂表面(下图中
分别表示N2、H2、NH3.在催化剂表面(下图中 表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:

 实验室常采用分解H2O2的水溶液(MnO2作催化剂)的方法制取氧气.
实验室常采用分解H2O2的水溶液(MnO2作催化剂)的方法制取氧气.