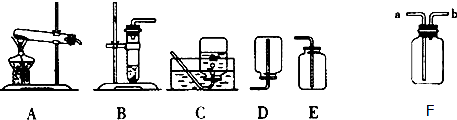
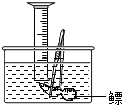
考点:常用气体的发生装置和收集装置与选取方法,量气装置,二氧化碳的实验室制法,氢气的制取和检验,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)据常用仪器回答;
(2)实验室制取氢气用锌和稀硫酸反应,不需加热,故选发生装置B,该装置可通过活塞的 开闭控制反应发生和停止;氢气密度比空气小且难溶于水,所以可用向下排空气法或排水法收集;
(3)据稀盐酸和石灰石反应原理书写方程式,并据加热碳酸氢钠反应原理书写方程式,该方法属于固体加热型,故选发生装置A,二氧化碳的密度比空气大且能溶于水,据此选择收集装置;
(4)植物油比水的密度小,能浮在水面上,可以起到隔绝二氧化碳与水的作用.
解答:解:(1)标号仪器分别是铁架台和集气瓶;
(2)用锌和稀硫酸反应制取氢气,反应物是固体和液体,反应不需要加热,应选择液固常温型发生装置,故选发生装置B,该装置可通过活塞的 开闭控制反应发生和停止;氢气密度比空气小,可以使用向下排空气法收集,难溶于水,可以使用排水法收集;
(3)石灰石的主要成分碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,反应方程式是CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;用碳酸氢钠(NaHCO
3)固体加热分解制取二氧化碳,2NaHCO
3Na
2CO
3+CO
2↑+H
2O;反应物是固体,反应需要加热,需要选择固体加热型发生装置,二氧化碳比空气的密度大,能溶于水,只能用向上排空气法收集;
(4)二氧化碳能与水反应,要测定生成的二氧化碳的体积,则生成的二氧化碳不能被消耗,而植物油浮在水面上能起到隔绝二氧化碳与水接触的作用,所以植物油上方的空气对实验结果没有影响;
故答案为:(1)铁架台;集气瓶;
(2)B;可随时控制反应的发生和停止;C;氢气的密度比空气小;E;氢气难溶于水;
(3)CaCO
3+2HCl═CaCl
2+CO
2↑+H
2O;2NaHCO
3Na
2CO
3+CO
2↑+H
2O;A、D;
(4)防止CO
2溶于水;无.
点评:此题考查了气体发生装置以及收集装置的选择,气体发生装置的选择要看反应物的状态和反应条件,气体收集装置的选择要看气体的密度与空气比较或看气体的溶解性.




 名校课堂系列答案
名校课堂系列答案