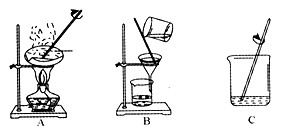
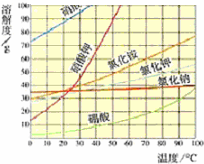
解:(1)观察图示可知,氯化钠随温度变化溶解度变化不大,所以夏天便于水分蒸发,且氯化钠随温度变化溶解度变化不大,有利用氯化钠析出,所以是夏天收盐.
故答案为:夏天便于水分蒸发,且氯化钠随温度变化溶解度变化不大,有利用氯化钠析出,所以是夏天收盐.
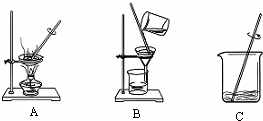
(2)粗盐提纯的主要步骤,
①溶解,将粗盐逐渐加入盛有水的烧杯里,边加边用玻璃棒搅拌(玻璃棒的作用是搅拌,加速溶解),直加到粗盐不再溶解时为止,观察所得食盐水是否浑浊;
②过滤,过滤食盐水,仔细观察滤纸上剩余物及滤液颜色,如滤液浑浊,应再过滤一次;
③蒸发,把所得滤液倒入蒸发皿,用酒精灯加热,待蒸发皿中出现较多固体时,停止加热,利用余热蒸干.
图中A是蒸发,B是过滤,C是溶解;B过滤实验中玻璃棒的作用是引流.
故答案为:CBA;蒸发;过滤;引流.
(3)加入适量的氯化钡溶液,可以将钡离子转化为沉淀,加过量碳酸钠溶液,可以将钙离子和反应剩余的钡离子转化为沉淀,加过量氢氧化钠溶液,可以将镁离子转化为沉淀,过滤可以将沉淀除去,加适量盐酸,可以除去反应剩余的碳酸根离子和氢氧根离子,最后的溶液中就只剩下了氯化钠和水,所以选择的药品和加药的正确顺序确是BaCl
2、Na
2CO
3、NaOH、HCl.
故选④.
(4)4.0g粗盐,得3.6g精盐可知,精盐的产率是:

×100%=90.0%.
故答案为:90.0%.
分析:(1)根据如图所示,氯化钠随温度变化溶解度变化不大,分析解题.
(2)粗盐提纯是通过溶解把不溶物与食盐初步分离、过滤把不溶物彻底除去、蒸发把食盐从溶液中分离出来而得到食盐的过程;其操作顺序应为溶解-过滤-蒸发.
(3)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去进行分析.
(4)根据提供的数据:4.0g粗盐,得3.6g精盐,分解解题.
点评:本题考查粗盐提纯的步骤、物质的除杂、产率的计算,需要同学们对粗盐提纯知识有较为全面的了解.



 ×100%=90.0%.
×100%=90.0%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案