
【题目】某兴趣小组在相同条件下,将10.00g下列物质分别置于相同规格的烧杯,并敞口存放于空气中,烧杯中物质质量随时间变化如下表,回答下列问题。
时间 | 质量/g | |||||
水 | 饱和石灰水 | 稀盐酸 | 浓硫酸 | 氢氧化钠浓溶液 | 氯化钙溶液 | |
1天 | 8.16 | 8.37 | 8.64 | 11.18 | 9.38 | 10.25 |
2天 | 5.76 | 5.94 | 6.69 | 12.55 | 8.47 | 10.33 |
(1)下列图示能反映水在空气中放置时发生变化的微观示意图是_________(填字母序号)。图中表示氧原子,表示氢原子)

(2)石灰水在空气中久置后有浑浊现象,写出该反应的化学方程式___________________。
(3)为研制一种安全、环保的除湿剂,可选择上表中的__________________(填溶质的化学式)。
(4)将10.00g氯化钠浓溶液敞口久置后,最终得到2.26g晶体,则该溶液是________(填“饱和”或“不饱和”)溶液。(已知该温度下氯化钠溶解度为36.1g)
(5)为进一步研究稀盐酸敞口久置后浓度变化,该小组开展如下探究。
①甲同学猜想浓度可能会变大,理由是_______________________。
②为验证甲同学的猜想是否正确,设计实验方案:_________________________。
(注意:若答对第(6)小题奖励4分,化学试卷总分不超过60分。)
(3)乙同学取20%的氢氧化钠溶液20.00g,敞口放置一段时间后部分变质,得到18.80g溶液,由此能否计算所得溶液中溶质组成?若能,请计算其组成;若不能,请补充完成实验方案设计,同时说明需要测定的数据(用a表示),并计算a的取值范围___________。(不要求写出计算过程)
【答案】 D Ca(OH)2+CO2=CaCO3↓ + H2O CaCl2 不饱和 稀盐酸中水的蒸发量大于HCl的挥发量 取等质量的原盐酸和久置的盐酸,均加酚酞溶液,分别滴入等浓度的NaOH溶液,至溶液由无色变红色时,比较消耗氢氧化钠的量(其他合理答案均给分) 不能。实验方案:将变质后溶液加热蒸干,称量所得固体质量为ag。a的取值范围:4.00<a<5.30。(本小题为开放性试题,其他合理答案均给分)
【解析】(1)水放置在空气中时表面的水分子会扩散到空气中,故选D;
(2)石灰水在空气中久置后有浑浊现象是由于氢氧化钙与空气中的二氧化碳反应生成碳酸钙沉淀和水,反应方程式为Ca(OH)2+CO2=CaCO3↓ + H2O;
(3)氯化钙溶液和浓硫酸溶液的质量增加,但是浓硫酸有强烈的腐蚀性,故选氯化钙溶液;
(4)该温度下氯化钠溶解度为36.1g,则该温度下10g浓溶液中最多能溶解氯化钠的质量为![]() ,故该溶液是不饱和溶液;
,故该溶液是不饱和溶液;
(5)①甲同学猜想浓度可能会变大,理由是稀盐酸敞口放置后有水分蒸发。
②为验证甲同学的猜想是否正确,设计实验方案:取等质量的原盐酸和久置的盐酸,均加酚酞溶液,分别滴入等浓度的NaOH溶液,至溶液由无色变红色时,比较消耗氢氧化钠的量;
(6)不能确定;实验方案:将变质后溶液加热蒸干,称量所得固体质量为ag。当没有变质时,蒸干后固体的质量为20g![]() =4g,设质量为4g的氢氧化钠完全变质后生成碳酸钠的质量为x
=4g,设质量为4g的氢氧化钠完全变质后生成碳酸钠的质量为x
2NaOH+CO2===Na2CO3+H2O
80 106
4.00g x
![]() =
=![]() ,解得x=5.30g,
,解得x=5.30g,
故a的取值范围:4.00<a<5.30


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:初中化学 来源: 题型:
【题目】为测定一种含碳酸钙的“石头纸”中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品,分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成气体的质量/g | 0.88 | 1.76 | X | 3.52 | 3.52 |
则求:(1)表中X的值为________;
(2)求样品中碳酸钙的质量分数________;
(3)烧杯④中物质充分反应后所得溶液的质量为____g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组利用氢气还原氧化铜,并用于测定水的元素组成,请合理选用下列装置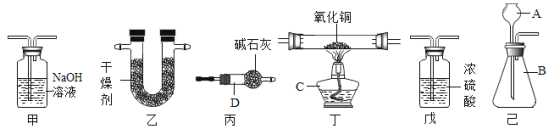 回答下列问题:
回答下列问题:
(1)组合装置己中氢气先用稀硫酸和锌粒反应制得,丁处用氢气还原氧化铜,可用于准确测定水的组成。为了防止杂质干扰,正确的连接顺序为:己→___→___→___→___→丙。其中乙装置的主要作用是 _________________ 。
(2)实验结束后,丁处的现象是黑色固体变成_____,则反应中的化学方程式为______;装置中的丙不能省去的原因是___________。
(3)若测得丁装置中样品在实验前后减少6.4g,乙装置中药品质量增加了7.2g,丙装置中碱石灰质量增加了3.6g,根据此可求出水中H、O质量比为(只写计算式)_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下列图示装置,回答下列问题.
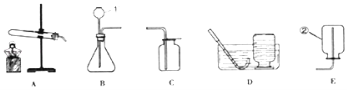
(1)写出编号所指仪器的名称:②_____。
(2)①利用AD装置制取氧气①反应原理为_____(用化学方程式表示)。
②为了使收集到的氧气较纯净,应等到_____时开始收集氧气。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“生命吸管”可直接将污水净化为饮用水,主要处理步骤与自来水的净化过程相似,如下图所示:(③中离子交换树脂的主要作用是去除重金属离子、软化水质)

(1)②中活性炭的作用是____(填字母。下同),④中超滤膜的作用是____。
A.去除有害菌和部分病毒 B.吸附杂质 C.除去较大的不溶性杂质
(2)若无生命吸管,取用河水时,要降低水的硬度和杀灭病原微生物,生活中常采取______方法。
(3)有的河水出现水华现象,经检测发现是河水中含有尿素、硫酸钾、磷酸二氢钾等而导致,上述三种物质属于复合肥的是___________。
(4)下列图标表示“国家节水标志”的是___________。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2015年诺贝尔化学奖表彰三位科学家在DNA修复机理研究贡献。阐明了在分子层面上细胞如何进行DNA修复,并确保其遗传信息安全的机制。请回答下列问题:
(1)DNA(脱氧核糖核酸)是一种解密生命密码的分子(见图),带有遗传信息的DNA片段被称为基因。细胞对DNA受损后进行基因修复,则DNA修复过程发生了______(填“物理”或“化学”)变化。修复机制确保了维持生命存在的遗传物质DNA的安全和稳定,这说明DNA分子能保持其______(填“化学”或“物理”)性质。

(2)细胞监控并修复紫外线对基因造成的侵害,分子修复功能适用于所有的生物。紫外线辐射改变DNA的化学结构,这一过程将_____能转化为化学能。
(3)细胞用来修复DNA的秘密武器是蛋白质,监控持续校对基因组,一旦发现基因发生受损,便对基因进行修复。下列物质不会使蛋白质发生化学变化,失去原有生理活性的是_____(填序号)。
a甲醛 b乙酸铅 c氯化钠 d尼古丁(烟碱)
(4)脱氧核糖是DNA的重要组成部分,其化学式为C5H10O4,则脱氧核糖属于_____(填“有机”或“无机”)化合物,其相对分子质量为___,其中碳、氢元素的原子个数比为_____,氧元素的质量分数为_____(计算结果精确到0.01%)。
(5)本年度获奖者发现三种基因修复机制和途径,打开了DNA修复研究领域的大门。神奇的DNA修复技术可应用到基因工程和现代医疗哪些方面?____________、______________(要求至少两点)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海洋中有丰富的资源,海水晒盐后,分离出食盐的海水称为苦卤水,其中含有丰富的MgCl2。工业上以苦卤水为原料制取金属镁(Mg)的流程如下:
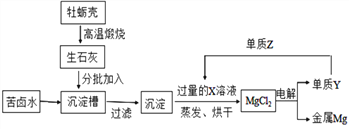
(1)从海水中析出食盐的结晶方法是______________
(2)Y与 Z 反应后的产物溶于水可得 X 溶液,从而实现了 Y 的循环利用,则 Z 的化学式为_____________
(3)烘干后得到的MgCl2中可能含有的杂质是_____________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢化油在中国普遍使用,被指会引起多种疾病。氢化油产生大量反式脂肪酸,被专家列入人类食物历史上最大的灾难之一,氢化油的化学式为 CH3(CH2) 16COOH,下列关于氢化油说法正确的是( )
A.氢化油中碳、氢、氧元素质量比为9:18:1
B.氢化油是由18个碳原子、36个氢原子、2个氧原子构成的
C.氢化油的相对分子质量是284
D.氢化油中氢元素的质量分数最大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】除去下列物质中混有的少量杂质(括号内为杂质),所用方法错误的是
A. ![]() 通过足量的碳酸氢钠溶液、干燥
通过足量的碳酸氢钠溶液、干燥
B. CaO固体(![]() )固体)--高温充分煅烧
)固体)--高温充分煅烧
C. NaCl固体(泥沙)--加人足量的水溶解、过滤、蒸发结晶
D. KCl溶液(![]() )溶液)--滴加氯化钡溶液至恰好完全反应,过滤
)溶液)--滴加氯化钡溶液至恰好完全反应,过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com