
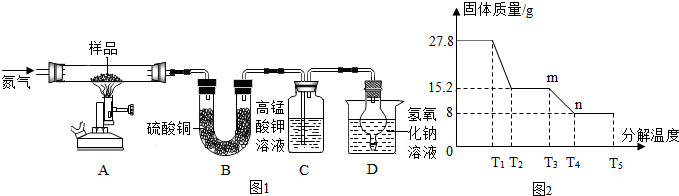
分析 (1)根据无水硫酸铜白色粉末遇水变蓝,所以常用来检验水的存在,二氧化硫能使高锰酸钾溶液褪色,所以常用来检验二氧化硫的存在进行分析;
(2)根据硫酸亚铁晶体加热时,先失去结晶水,高温会继续分解生成氧化铁、二氧化硫和三氧化硫,结合图象中的数据进行计算.
解答 解:(1)无水硫酸铜白色粉末遇水变蓝,所以常用来检验水的存在,二氧化硫能使高锰酸钾溶液褪色,所以常用来检验二氧化硫的存在,所以硫酸亚铁晶体完全分解后,装置A中的固体变为红棕色的Fe2O3,装置B中硫酸铜粉末变蓝,说明产物中有水,装置C中的现象是紫色的高锰酸钾溶液褪色;
(2)通过图象中的数据可以看出,第一次固体质量减少是硫酸亚铁晶体分数分解,第二次固体质量减少是硫酸亚铁分数分解,所以
设生成二氧化硫的质量为x
2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO3↑+SO2↑
304 160 64
15.2g 8g x
$\frac{160}{8g}$=$\frac{64}{x}$
x=3.2g
故答案为:(1)水,紫色的高锰酸钾溶液褪色;
(2)生成二氧化硫的质量是3.2g.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 热固性塑料和热塑性塑料,可加热观察外形变化 | |
| B. | 用排水法收集O2结束时,先熄灭酒精灯,后移出导管 | |
| C. | 用稀H2SO4区别NaOH、K2CO3、BaCl2三种白色固体 | |
| D. | 为区别化肥硝酸钾和硝酸铵用加入熟石灰研磨闻气味 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
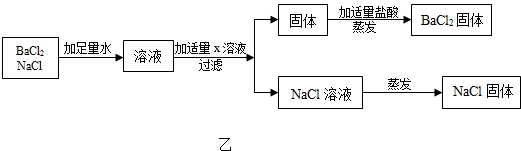
 同学,们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究.
同学,们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究.| 方案 | 加入试剂 | 分离方法 | 方案评价 |
| 一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | 不可行,理由是:引进新杂质 |
| 二 | 稍过量的盐酸 | 蒸发结晶 | 可行 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com