
 同学,们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究.
同学,们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究.| 方案 | 加入试剂 | 分离方法 | 方案评价 |
| 一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | 不可行,理由是:引进新杂质 |
| 二 | 稍过量的盐酸 | 蒸发结晶 | 可行 |
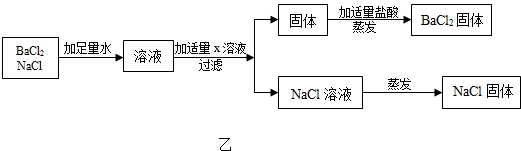
分析 [推理假设]根据碳酸钠与盐酸反应的实质写出其反应的化学方程式;
[实验探究]
(1)①判定废液中是否含盐酸所取用的酸碱指示剂不能用酚酞试剂,因酸不能使无色的酚酞变色;②明确镁和盐酸反应出现的现象;
(2)测定溶液的酸碱性的最简单方法用pH试纸;
(3)根据化学上除杂质原则分析实验方案设计,即除去原杂质不能添加新的杂质.
(4)根据该物质和氯化钡反应产生沉淀,且不能引进新的杂质,生成氯化钠考虑.
解答 解:[推理假设]反应物是碳酸钠和盐酸,生成物是氯化钠、水和二氧化碳,用观察法配平,二氧化碳后面标上上升符号,所以反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
[实验探究]
(1)①判定废液中是否含盐酸所取用的酸碱指示剂不能用酚酞试剂,因酸不能使无色的酚酞变色,故取用石蕊试液,酸能使石蕊试液变红色;
②镁和盐酸反应出现的现象是产生大量气泡,如没气泡产生则证明废液中一定没有盐酸;
(2)测定溶液的酸碱性的最简单方法用pH试纸(也可使用pH计);
(3)根据化学上除杂质原则分析实验方案设计,即除去原杂质不能添加新的杂质,因而处理废液,回收利用废液中得到纯净的NaCl时,如加适量Ca(NO3)2溶液,虽然除去了碳酸钠,但却引进新杂质NaNO3;如加入过量的稀盐酸蒸发结晶后可得到纯净的氯化钠.
(4)碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,既除去了氯化钡,还没有引入新的杂质.
故答案为:
[推理假设]Na2CO3+2HCl=2NaCl+H2O+CO2↑;
[实验探究](1)①石蕊;②无气泡产生(或无现象或无变化);(3)
| 方案 | 加入试剂 | 分离方法 | 方案评价 |
| 引进新杂质(或有NaNO3,生成或引进NO3-) | |||
| 盐酸(或稀HCl或HCl) | 蒸发结晶 |
点评 此题考查探究酸的性质及书写有关化学方程式,题型设计科学合理,能很好的培养学生对酸的知识系统化,不再机械记忆,囫囵吞枣的记忆酸碱盐的知识点.


科目:初中化学 来源: 题型:选择题
 砷化镓(GaAs)是一种“LED”绿色节能光源材料,镓元素的相关信息如图.下列有关镓的说法正确的是( )
砷化镓(GaAs)是一种“LED”绿色节能光源材料,镓元素的相关信息如图.下列有关镓的说法正确的是( )| A. | 属于非金属元素 | B. | 原子的核内质子数是31 | ||
| C. | 原子的核内中子数是31 | D. | 1个镓原子的质量为69.72g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 单质 | B. | 原子 | C. | 元素 | D. | 分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com