

分析 (1)根据铁生锈的条件解答;铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水;
(2)①从控制变量的角度进行分析;②若铁的活动性强于铜,则铁可置换出硫酸铜中的铜.
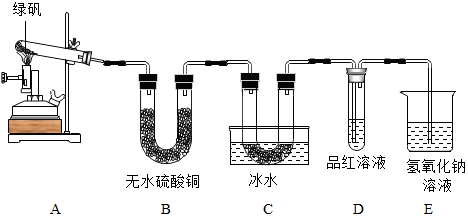
(3)①二氧化碳与氢氧化钠反应生成碳酸钠和水;②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后还原反应器中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后二氧化碳吸收瓶增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.
解答 解:(1)钢铁的锈蚀,实际上是铁跟水和氧气共同作用的结果;
铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水,反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(2)①从图可以看出选取的酸的种类不同,因此以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱不够合理;故答案为:选取的酸的种类不同;
②实验二中,若铁丝表面出现红色物质,溶液由蓝色变成浅绿色,可证明铁的活动性强于铜,该反应的化学方程式为Fe+CuSO4═FeSO4+Cu;
(3)①二氧化碳与氢氧化钠反应生成碳酸钠和水,化学方程式为2NaOH+CO2=Na2CO3+H2O;
②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后还原反应器中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.所以,要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是反应后装置B增加的质量或反应后装置A中样品减少的质量.
故答案为:
(1)氧气、水蒸气,Fe2O3+6HCl=2FeCl3+3H2O;
(2)①选取的酸的种类不同;②铁丝表面出现红色物质;Fe+CuSO4═FeSO4+Cu;
(3)①2NaOH+CO2=Na2CO3+H2O;②反应后装置B增加的质量或反应后装置A中样品减少的质量.
点评 本题难度不大,综合性较强.掌握常见合金、钢铁锈蚀的原理和除锈原理是解决本题的关键.


科目:初中化学 来源: 题型:填空题
 a、b、c三种固体物质的溶解度曲线如图所示,请回答:
a、b、c三种固体物质的溶解度曲线如图所示,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁粉 | B. | 纯碱 | C. | 氢氧化钠固体 | D. | 粗盐 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫在空气中燃烧,发出蓝紫色火焰,产生有刺激性气味的气体 | |
| B. | 铁丝在氧气中燃烧,火星四射,放出热量,生成黑色固体 | |
| C. | 红磷在空气中燃烧产生大量的白雾 | |
| D. | 蜡烛在氧气中燃烧产生大量的白烟 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 区别面粉和米粉-------加碘酒 | |
| B. | 鉴别KCl溶液和CaCl2-------分别加入硝酸银 | |
| C. | 除去H2气体中的NH3气体-------先通入水再通入浓硫酸 | |
| D. | 除去粗盐中的氯化镁、硫酸镁杂质--------溶解、过滤、蒸发、结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com