将60克铁粉和铜粉的混合物放入足量的硫酸铜溶液中,完全反应后,共得红色沉淀68克,求原混合物中铜的质量分数.
【答案】
分析:红色沉淀为铜,68g铜有两个来源,一个是混合物中的铜,一个是反应生成的铜,可以设出混合物中铜的质量为x,则生成的铜的质量就是68g-x,铁粉的质量就是60g-x,通过化学方程式计算出x的质量,然后求出铜的质量分数.
解答:解:设混合物中铜的质量为x,则铁粉的质量为60g-x,生成的铜的质量为68g-x
Fe+CuSO
4=FeSO
4+Cu
56 64
60g-x 68g-x
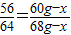
x=4g
故原混合物中铜的质量分数为:
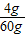
×100%=6.25%
答:原混合物中铜的质量分数为6.25%.
点评:区分开68g铜有两个来源是正确解决本题的关键.
