
����Ŀ����13�֣�ҽѧ�Ͼ�����������������Ƭ��ƶѪ���߲�����ij��ȤС���ͬѧ������Ƭ����������������Ʊ�����ɲ�������Ȥ���������̽����
̽��������ʵ���ҵķ�ˮ����ͭ���Ʊ������������塣

��1������ٵĻ�ѧ����ʽ�� ��
��2��������к��е������� (�ѧʽ����ͬ) ����ɫ������ ����Һ���е������� ��
̽�����������������壨FeSO4xH2O���Ļ�ѧʽ��
���������ϡ�
��1����ˮ����ͭ��ĩ��ˮ������ɫ������ͭ���塣
��2�����������������ʱ����ʧȥ�ᾧˮ�������������ֽ�����������������̬�ǽ��������
������ʵ�顿
����ȤС��ͬѧ��ȡ2.78g�����������壨FeSO4xH2O����Ʒ��ͼ1װ�ø��¼��ȣ�ʹ����ȫ�ֽ⣬�������ò�����з�����������SDTQ600�ȷ����Ƕ��������������ȷֽ���������ݣ����Ƴ�ͼ2��ʾ��ϵͼ��

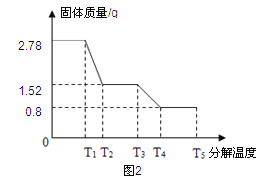
�����ݷ�����
��1��ͼ1װ��B����ˮ����ͭ��ĩ������˵���������� �������ʵ�����Ϊ g��
��2��T3��ʱ�������Ļ�ѧ��ӦΪ��2FeSO4���� Fe2O3+X��+SO3��������X�Ļ�ѧʽ
��
��3��װ��C������������Һ�������� ��
��4����֪FeSO4xH2O �� FeSO4 + xH2O��
����FeSO4xH2O�е�x����д��������̣�
���������ۡ�ʵ����Ҫ����ͨ�뵪������������xֵ�� ����ƫ��ƫС�䣩��
���𰸡�̽������1��Fe+CuSO4=FeSO4+Cu
��2��Fe��Cu Cu FeSO4 ��Al2(SO4)3
̽�����������ݷ�������1��H20 1.26 ��2��SO2
��3�����ն��������������������ֹ��Ⱦ���� ��4��7 ��5�� ƫС
��������
���������̽������1�����ݽ����Ļ��˳��������ͭ��ǰ�棬��������ٵĻ�ѧ����ʽ����Fe+CuSO4=FeSO4+Cu
��2�����ڲ������û�����ͭ���������ǹ���������������к��е���������Fe��Cu���ڹ��������м���ϡ���ᣬ������ϡ���ᷴӦ��������ɫ������Cu����Һ���е�������δ��Ӧ��Al2(SO4)3��FeSO4�����з�Ӧ���ɵ�FeSO4��������Һ���е�������FeSO4 ��Al2(SO4)3
̽�����������ݷ�������1���������ϣ���ˮ����ͭ��ĩ��ˮ������ɫ������ͭ���������ͼ1װ��B����ˮ����ͭ��ĩ������˵����������H20�������ʵ������ɸ���ͼ2�жϣ�2.78g-1.52g=1.26g
��2�����������غ㶨�ɵ��۽��ͣ���ѧ��Ӧǰ��ԭ�ӵ�������������䣬�����ѧ��ӦΪ��2FeSO4 Fe2O3+X��+SO3���������Ƴ�X�Ļ�ѧʽSO2
��3����ΪFeSO4���ȷֽ�����SO2 ��SO3����һ�ִ�����Ⱦ�����װ��C������������Һ�������������ն��������������������ֹ��Ⱦ����
��4�����ݷ���ʽ��FeSO4xH2O��FeSO4��H2O��������ϵ���������X��ֵ
����һ�� FeSO4xH2O �� FeSO4 + xH2O
152+18x 18x
2.78g 1.26g
(152+18x)/ 2.78g = 18x/ 1.26g
���x=7
��������FeSO4xH2O �� FeSO4 + xH2O
152 18x
1.52g 1.26g
152/ 1.52g=18x/ 1.26g
���x=7
��5��ʵ����Ҫ����ͨ�뵪�������ǽ�FeSO4xH2O���ȷ�Ӧ�в���������ȫ�����뵽װ��B��C�У�ʹ��ʣ���������ƫ�������xֵ��ƫС


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ��������ֽ�IJ�������������������ת����ϵ���������ѧ֪ʶ��Ҫ����գ�
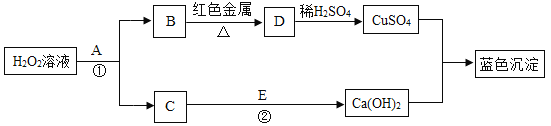
��1��A�ڷ�Ӧ������ ���ã���ɫ�����Ļ�ѧʽΪ ��
��2����Ӧ���Ļ�ѧ��Ӧ����ʽΪ ��
��3����ɫ�������� ����ᡱ��������Ρ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���Ӧ��ͼ����ȷ���� �� ��
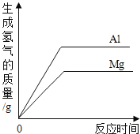
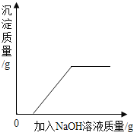
A B C D
A������������þ�����ֱ������������ᷴӦ
B����pH=2�������еμӹ���������������Һ
C�������������ͭ�Ļ����Һ�м������������������Һ
D����pH=12������������Һ�м�ˮϡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�У������������������ǣ�
A. �������� B. ũ�ҷ��ϸ��� C. ������� D. ţ�̱���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧʵ�����������������ȷ����
A. þ���ڿ���ȼ�գ�����ҫ�۵İ⣬�ų������ȣ����ɰ�ɫ����
B. �����ڿ�����ȼ�գ�������������
C. ľ̿��������ȼ�շ����⣬���ɶ�����̼
D. ϸ��˿��������ȼ�գ��������䣬���ɺ�ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ó涣ҧʱ���ڵ����ᣨHCOOH����ʹ����Ƥ��ʹ���������й������˵����ȷ����
A�������������� B��������̼���⡢������ԭ�ӹ���
C��������̼����Ԫ�ص�������Ϊ1�U2 D����������Ԫ�ص�����������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
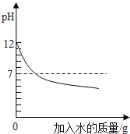
����Ŀ�����ֲ����ᾧˮ�Ĺ������ʼס��ҡ������ܽ����������ͼ������˵����ȷ����
A����t1��ʱ���������ʵı�����Һ������t2��ʱ��������Һ�ĵ���������������С˳���ǣ���>��>��
B����t2��ʱ���ס�����������Һ�к�����������һ�����
C���ס��ҡ����������ʵı�����Һ���¶���ת��Ϊ��������Һ
D��Ҫ�Ӻ�������������Һ�еõ��϶���Ҿ��壬ͨ����
���ý��½ᾧ�ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(11��) ��1������Ҫ��д���±���Ӧ�Ļ�ѧ���š�
���� | 2����ԭ�� | ���������� | ��������� | +6�۵���Ԫ�� |
��ѧ���� |
��2��Ϊ������Ⱦ�����������Դ�����ͳ��Դ������ȼ�յĻ�ѧ����ʽΪ ����ȼ����Ҫ�ɷ�Ϊ���飨CH4���������� ���������л������
��3��ͭ��Ũ���ᷴӦҲ������һ�ִ�����Ⱦ���Ӧ����
Cu + 4 HNO3 = Cu(NO3)2 + 2 X�� + 2 H2O����X�Ļ�ѧʽΪ ��
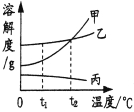
��4����ͼ��A��B��C���ֹ������ʵ��ܽ�����ߡ�
��t1��ʱ�����������ܽ�ȵĴ�С��ϵ�� ��
��t2��ʱ����30gB����Ͷ��100gˮ�У�����ܽ��ɵõ�����
��Һ��������͡��������͡��� ������ȷ��������
��������A��Һ��Ϊ��������Һ�����еķ���֮һ�����£��������õķ����� ��
��A�к�����B����Ҫ�ᴿA���ɲ��� ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ڱ�����������Լ��Դ����
A���Բ����� B�����ֹص� C���������� D����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com