
分析 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
解答 解:(1)铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
(2)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
(3)过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(4)实验室常用石灰石与稀盐酸反应制取二氧化碳,同时生成氯化钙、水,反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑.
故答案为:(1)3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;(2)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;(3)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;(4)CaCO3+2HCl=CaCl2+H2O+CO2↑.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 由同种元素组成的物质一定是单质 | |
| B. | 由不同种元素组成的物质一定是化合物 | |
| C. | 单质一定由同种元素组成 | |
| D. | 含氧化合物一定由两种元素组成 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ②③⑥ | B. | ①②④⑤⑥ | C. | ①③④⑥ | D. | ①②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质是由微粒构成的 | B. | 构成物质的微粒不断运动 | ||
| C. | 任何微粒都是不可再分的 | D. | 组成物质的基本成分是元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
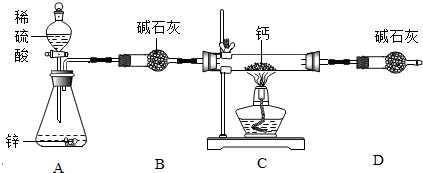
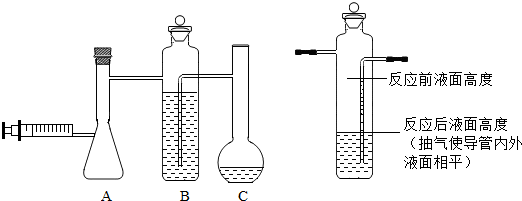
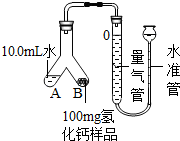
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com