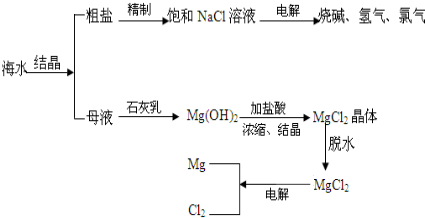
(2012?道外区二模)工业上利用海水提取食盐的过程:
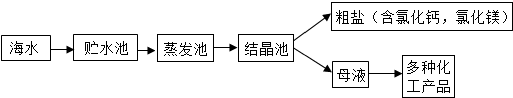
[提出问题]析出的粗盐中含有CaCl
2和MgCl
2吗?
化学课外小组的同学取粗盐,并进行如下实验:
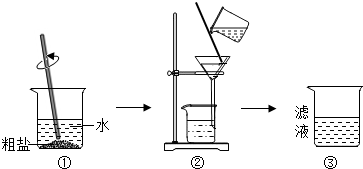
[进行假设]滤液中含有CaCl
2和MgCl
2,其它杂质不干扰实验现象
[实验与评价]为了证明假设成立,大家一致认为只需证明Ca
2+和Mg
2+即可
小明设计的方案是:取烧杯③中的溶液,向其中滴加氢氧化钠溶液,若产生白色沉淀,过滤,向所得滤液中再滴加碳酸钠溶液,再次产生白色沉淀,则假设成立,请你进行评价①
该实验方案应该加入过量的氢氧化钠溶液
该实验方案应该加入过量的氢氧化钠溶液
;
小刚的方案是:利用不同于小明的一种无色溶液和一种无色气体设计方案,若他的方案正确,请你猜出他的方案可能是②
取烧杯③中的溶液,向其中滴加过量氢氧化钠溶液,若产生白色沉淀,过滤,向所得滤液中通入二氧化碳气体,再次产生白色沉淀,则假设成立
取烧杯③中的溶液,向其中滴加过量氢氧化钠溶液,若产生白色沉淀,过滤,向所得滤液中通入二氧化碳气体,再次产生白色沉淀,则假设成立
;
[反思交流]在对粗盐混合液过滤时,过滤浑浊,原因可能是③
滤纸破损或过滤时液面高于滤纸的边缘等
滤纸破损或过滤时液面高于滤纸的边缘等
,
[拓展应用]工业上得到粗盐后,为了除去氯化钙和氯化镁等杂质,而得到精盐氯化钠,采取有关溶液的知识除杂,方法是④
将粗盐加水溶解,加过量氢氧化钠溶液和过量碳酸钠溶液后充分反应后过滤,然后向滤液中加入盐酸除去多余的氢氧化钠和碳酸钠,蒸发结晶即可得到纯净的氯化钠
将粗盐加水溶解,加过量氢氧化钠溶液和过量碳酸钠溶液后充分反应后过滤,然后向滤液中加入盐酸除去多余的氢氧化钠和碳酸钠,蒸发结晶即可得到纯净的氯化钠
.