
【题目】在密闭容器内进行的某反应,测得反应前(t0)、反应中(t1)、反应后(t2)不同时刻甲、乙、丙、丁四种物质的质量分数分别如下图所示。下列说法不正确的是
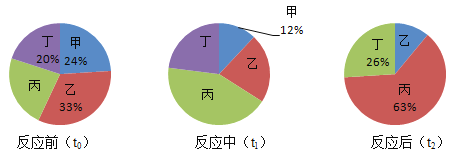
A. 该反应中,甲和乙是反应物,丙和丁是生成物
B. t1时刻,乙、丙、丁所占的质量分数分别为22%、43%和23%
C. 若甲和丁分别是镁和碳,则该反应中甲和丁的化学计量数之比1:2
D. 若反应前四种物质的总质量为100g,如果再增加12g甲,则甲与乙可恰好完全反应
【答案】C
【解析】
A、该反应中甲、乙质量减少,是反应物,丙、丁质量增加,是生成物,该选项说法正确;
B、反应前丙的质量分数是1-20%-24%-33%=23%,反应后乙的质量分数为1-26%-63%=11%,参加反应的甲、乙、丙、丁的质量比为24%:(33%-11%):(63%-23%):(26%-20%)=12:11:20:3,t1时刻,甲反应掉12%,则乙反应掉11%,丁、丙分别生成3%、20%,因此乙、丁、丙所占的质量分数分别为22%、23%和43%,该选项说法正确;
C、若甲和丁分别是镁和碳,则该反应中甲和丁的化学计量数之比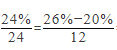 =2:1,该选项说法不正确。
=2:1,该选项说法不正确。
D、若反应前甲、乙、丙、丁四种物质的总质量为100克,则反应前甲的质量为24g,乙33g,再增加12克甲,则反应前甲乙质量比为(24g+12g):33g=12:11,所以甲与乙则恰好完全反应,该选项说法正确;
故选:C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】下列图象能正确反映对应变化关系的是( )
A. 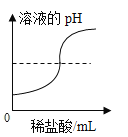 向NaOH溶液中逐滴加入稀HCl
向NaOH溶液中逐滴加入稀HCl
B.  将浓H2SO4露置在空气中
将浓H2SO4露置在空气中
C. 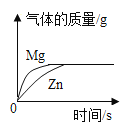 足量粉末状金属分别与等质量、等浓度的稀盐酸反应
足量粉末状金属分别与等质量、等浓度的稀盐酸反应
D.  一定质量的饱和石灰水中加入生石灰
一定质量的饱和石灰水中加入生石灰
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种物质的溶解度曲线,下列说法正确的是( )

A.甲的溶解度大于乙的溶解度
B.t2℃时,甲物质的溶解度是50
C.t1℃时,甲、乙两种物质的饱和溶液中,溶质质量分数相等
D.当乙中含有少量甲时,可以通过冷却热饱和溶液的方法提纯乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属活动性顺序有重要的应用。铝、铜、铁为日常生活中常见的金属,某化学小组的同学在探究铝、铜、铁三种金属的有关性质时,进行了如图所示的实验:
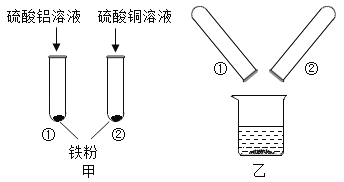
(1)在甲实验②号试管中能观察到的实验现象是_____。
(2)将甲实验结束后①②试管内的物质倒入烧杯中,一段时间后对烧杯中的物质进行过滤,滤液中的溶质一定有_____。
(3)若要验证铝、铁、铜金属活动性顺序,还可以用一种试剂直接与上述金属反应就能达到目的,该试剂可以是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某纯碱样品中含有少量NaCl,小丽同学取该样品23g全部溶解于150g水中,再逐滴加入160g稀盐酸,反应中产生的气体的质量与盐酸的用量关系如图所示。(提示:相关反应为Na2CO3+2HCl=2NaCl+H2O+CO2↑)计算当恰好完全反应时:
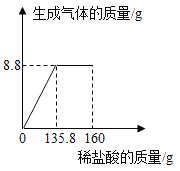
(1)产生的二氧化碳的质量是 克。
(2)此时所得到的溶液中溶质的质量分数(写出必要的计算过程,结果保留到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(实验回顾)在烧杯中加入约 5mL 稀氢氧化钠溶液,滴入几滴酚酞溶液。用滴 管慢慢滴入稀盐酸,并不断搅拌。
(1)该实验证明了盐酸和 NaOH 溶液能发生化学反应,依据的现象是_____。
(2)反应的化学方程式为_____。
(探究活动 1)通过证明有水生成来证明酸和碱之间反应的发生。
(查阅资料)a.变色硅胶吸水后由蓝色变为红色;b.无水醋酸是一种酸,常温下为无色液体。
(设计实验)取变色硅胶、无水醋酸和氢氧化钠固体进行如图 1 所示的实验。
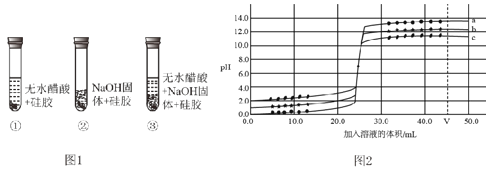
(1)加入试剂后,要迅速塞紧橡胶塞的原因是 _____。
(2)上述实验中能证明酸和碱反应有水生成的现象是_____。
(探究活动 2)通过 pH 变化来证明酸和碱之间反应的发生。图 2 为三种不同浓度的氢氧化 钠溶液与对应浓度盐酸反应的曲线。
(1)该实验是_____(填字母)。
A 将盐酸加入氢氧化钠溶液中 B 将氢氧化钠溶液加入盐酸中
(2)三条曲线所示实验中,所用盐酸浓度最大的是_____(填“a”、“b”或“c”)。
(3)加入溶液体积为 VmL 时,所得溶液中溶质是_____(写化学式)。
(拓展延伸)某同学查阅资料得知常温下 pH 与溶液中 H+浓度有如下关系:
H+浓度(单位略) | 0.1 | 0.01 | 0.001 | 0.0001 | … |
pH | 1 | 2 | 3 | 4 | … |
(1)pH=6 时溶液中 H+的浓度为_____。
(2)下列说法正确的是_____(填字母)。
A H+浓度越大,pH 越小
B pH=1 的盐酸与 pH=3 的盐酸混合后,所得溶液 pH 为 2
C 测定盐酸的 pH 时,先将 pH 试纸用水润湿,再将待测液滴在 pH 试纸上
D 向两份相同的稀盐酸中分别加等体积的水和氢氧化钠溶液,溶液 pH 增大程度相同
(3)推测将 pH=5 的盐酸加水稀释至 1000 倍时,溶液的 pH_____(填字母)。
A 等于 6 B 等于 7 C 等于 8 D 以上都不对
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,下列有关说法正确的是
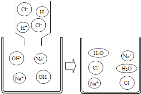
A. 反应前后,溶液的pH不变
B. 反应前后,Na+和Cl-的数目不变
C. 反应前后,H+和OH-的数目不变
D. 反应前后,H2O的数目不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定标有质量分数为32%的盐酸的实际质量分数,小明实验时先在烧杯中加入20 g 40%的氢氧化钠溶液,再逐滴加入该盐酸,测定出加入盐酸的质量与烧杯中溶液pH的关系如图。
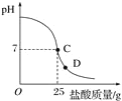
(1)所用氢氧化钠溶液中溶质的质量为_____g。
(2)请认真看清上图信息后回答以下问题。
①当滴加盐酸到C点时,所消耗的盐酸中溶质的质量是多少?_____。
②该盐酸的实际质量分数是多少?(保留到0.1%)_____。
③导致盐酸溶液的溶质质量分数改变的原因是_____。
④当滴加盐酸到图像中D点时,烧杯中溶液的溶质是_____(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一
系列化工产品,称为氯碱工业。在工业上,制取氯气和烧碱的主要工艺流程如下:

环节Ⅰ:利用海水提取粗盐的过程(如图)。

(1)图中①是 (填“蒸发”或“冷却”)池。
(2)母液为氯化钠的 (填“饱和”或“不饱和”)溶液。
环节Ⅱ:利用工业上粗盐(含MgCl2、CaCl2、Na2SO4等杂质)精制氯化钠(工艺流程如下图)。

(1)X中含有的阳离子是 ;
(2)写出生成沉淀D的一个化学方程式 。
(3)溶液E中加过量稀盐酸的作用是 。
(4)实验所得精盐的质量大于粗盐中NaCl的质量,原因是 。
环节Ⅲ:电解饱和食盐水生产氯气和烧碱并测定烧碱的纯度。
(1)请写出环节Ⅲ生产中发生反应的化学方程式 。
(2)工业烧碱常常含有一定的氯化钠和碳酸钠杂质。为了测定烧碱的含量,小婉同学设计探究方案后进行实验并测得数据如图:

你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程) 。
(3)小强同学认为小婉同学设计的探究方案不够严密,其理由是:
①探究方案中没考虑氢氧化钠的吸水性。
②探究方案中因缺少 (填操作名称),导致测得的氢氧化钠的质量分数偏小。
环节Ⅳ:应用举例
氯气与氢氧化钠溶液反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,工业上用氯气与石灰乳[Ca(OH)2]反应来制取漂白粉,有关反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com