


科目:初中化学 来源: 题型:阅读理解
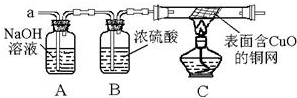
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
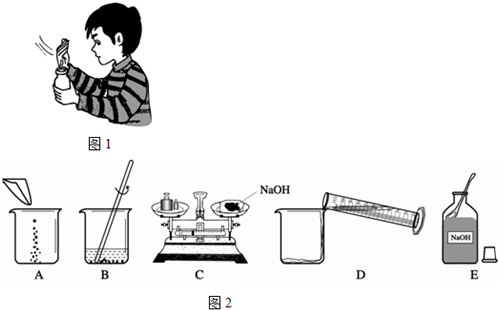
查看答案和解析>>
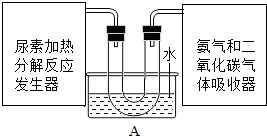
科目:初中化学 来源: 题型:
 亚硝酸钠(化学式为NaN02)是一种常用的防腐剂.亚硝酸钠是一种淡黄色或白色晶体,有咸味,易潮解,易溶于水,其水溶液呈碱性;在320℃时能分解产生氧化钠固体、一氧化氮气体和一种常见的助燃性气体.亚硝酸钠有毒性,能将人体血红蛋白中的+2价亚铁离子转
亚硝酸钠(化学式为NaN02)是一种常用的防腐剂.亚硝酸钠是一种淡黄色或白色晶体,有咸味,易潮解,易溶于水,其水溶液呈碱性;在320℃时能分解产生氧化钠固体、一氧化氮气体和一种常见的助燃性气体.亚硝酸钠有毒性,能将人体血红蛋白中的+2价亚铁离子转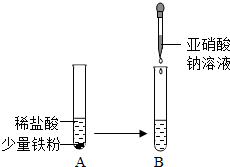
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com