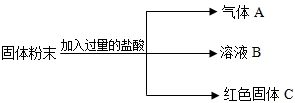
有一包固体粉末,可能含有碳酸钙、硫酸铜、硝酸钾、硫酸钠、氯化钡中的一种或几种.为确定其组成,进行如下实验:
(1)取该固体粉末少量加足量水,搅拌,静置,得到白色沉淀,上层为无色溶液;
(2)过滤,在白色沉淀中加入足量稀硝酸,白色沉淀不溶解.
根据以上实验可推断原固体粉末中一定有的物质是______;一定没有的物质是______;不能确定的物质是______;为确定这包固体粉末的组成,小华取原固体粉末8.00g加足量水充分溶解后,其粉末中的成分恰好完全反应,过滤,将沉淀洗涤、干燥.称得其质量为4.66g.通过计算后,确定这包固体粉末的组成是______.
解:取该固体粉末少量加足量水,搅拌,静置,上层为无色溶液,说明一定不存在硫酸铜,在白色沉淀中加入足量稀硝酸,白色沉淀不溶解说明一定不存在碳酸钙,一定存在氯化钡和硫酸钠,对于硝酸钾,题中的现象不能判断,
设生成4.66克的沉淀需要氯化钡的质量为x,硫酸钠的质量为y,
BaCl
2+Na
2SO
4=2NaCl+BaSO
4↓
208 142 233
X Y 4.66
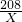
=
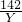
=
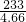
X=4.16g
y=2.84g
所以氯化钡和硫酸钠的质量之和4.16+2.84=7克<8克,一定存在硝酸钾,
故答案为:Na
2SO
4 BaCl
2;CaCO
3 CuSO
4;KNO
3;Na
2SO
4 BaCl
2 KNO
3分析:根据不溶于硝酸的白色沉淀有硫酸钡和氯化银,碳酸钙沉淀会溶于酸,铜离子在溶液中显蓝色进行分析;
根据沉淀的质量计算硫酸钠和硝酸钡的质量,然后与8克比较分析;
点评:在解此类题时,先根据题中的现象确定存在的物质或不存在的物质,对于现象不能判断的,再设计实验验证.

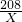 =
=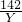 =
=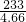


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案