
【题目】2018年5月13日,我国首艘001A型国产航母开始海试,标志着我国在航海及军事领域取得重大突破。根据所学知识填空。
(1)建造航母用到了钛合金,构成金属钛的粒子是________(填“原子”“分子”或“离子”),工业制钛有一种反应为:TiF4+2H2SO4![]() 4HF+2X+TiO2,X 的化学式为_______。
4HF+2X+TiO2,X 的化学式为_______。
(2)航母外壳用涂料覆盖,是为了防止钢铁材料与_______________接触而锈蚀。
(3)为了探究航母材料中锌、铁、铜三种金属活动性强弱,某同学设计了下列实验(每步均充分反应),其中能达到目的是________________(填序号)。
A.稀盐酸中加入足量铁粉后,再加铜粉,最后加入锌粉
B.ZnCl2溶液中加入足量铁粉后,再加入CuCl2溶液
C.ZnCl2溶液中加入足量铜粉后,再加入铁粉
【答案】 原子 SO3 水和氧气 AB
【解析】本题主要考查了质量守恒定律,金属锈蚀的原理,探究金属的活动性顺序等。难度不大,根据已有的知识进行分析解答。
(1)金属是由原子直接构成,构成金属钛的粒子是原子;根据TiF4+2H2SO4![]() 4HF+2X+TiO2可知,反应物中有1个钛原子,4个氟原子,4个氢原子,2个硫原子,8个氧原子,生成物中有4个氢原子,4个氟原子,1个钛原子,2个氧原子和2X;根据质量守恒定律可知,在化学反应前后原子种类、个数不变,2X中有 2个硫原子,6个氧原子,X 的化学式为SO3;
4HF+2X+TiO2可知,反应物中有1个钛原子,4个氟原子,4个氢原子,2个硫原子,8个氧原子,生成物中有4个氢原子,4个氟原子,1个钛原子,2个氧原子和2X;根据质量守恒定律可知,在化学反应前后原子种类、个数不变,2X中有 2个硫原子,6个氧原子,X 的化学式为SO3;
(2) 铁与氧气、水同时接触就会生锈。航母外壳用涂料覆盖,是为了防止钢铁材料与水和氧气接触而锈蚀;
(3)A、稀盐酸中加入足量铁粉后,能产生气泡和氯化亚铁,再加铜粉,无明显变化,说明铜不能与氯化亚铁反应,则铁的活动性大于铜,最后加入锌粉,锌粉表面有金属析出,说明锌能与氯化亚铁反应,则锌的活动性大于铁。该实验能探究锌、铁、铜三种金属活动性强弱,正确;B、ZnCl2溶液中加入足量铁粉后,无明显变化,说明铁不能与ZnCl2反应,则铁的活动性小于锌,再加入CuCl2溶液,铁的表面覆盖一层红物质,说明铁的活动性大于铜,该实验能探究锌、铁、铜三种金属活动性强弱,正确;C、ZnCl2溶液中加入足量铜粉后,无明显变化,说明铜不能与ZnCl2反应,则铜的活动性小于锌,再加入铁粉,无明显变化,说明铁不能与ZnCl2反应,则铁的活动性小于锌,无法比较铜、铁的活动性,该实验不能探究锌、铁、铜三种金属活动性强弱,错误。故选AB。


科目:初中化学 来源: 题型:
【题目】下图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
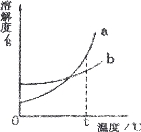
A.a中含有少量b时,一般用蒸发溶剂的方法提纯a
B.t℃时,a、b饱和溶液中含有的溶质质量a大于b
C.当温度大于t℃时,a溶液一定比b溶液浓
D.a物质的溶解度受温度变化的影响较大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所列的是一些常见的实验装置和基本操作:
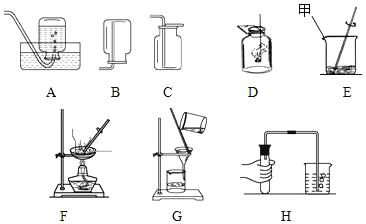
回答下列问题:
(1)仪器甲是_____.
(2)在A、B、C中属于向下排气法收集的气体的是_____(填序号).
(3)F实验操作名称叫_____,H实验操作名称叫_____;G中的玻璃棒在实验中起_____作用.
(4)将在空气中点燃的棉花迅速伸入盛满氧气的冷而干燥的集气瓶D中,待燃烧完成后,证明棉花中含有氢元素的实验现象是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】刘彬同学父亲得知某地盛产石灰石,准备兴建一座碳酸钙精粉厂.为检测当地石灰石中碳酸钙的纯度,他在实验室用6g石灰石样品(杂质不参加反应)与19g稀盐酸恰好完全反应,测得残留物为22.8g.求:
(1)依椐质量守恒定律,生成二氧化碳_____g.
(2)样品中碳酸钙的质量分数_____.
(3)所用稀盐酸溶液中溶质的质量分数_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国著名化学家侯德榜发明的“联合制碱法”的反应原理用化学方程式可简要表示为:①NH3+CO2+H2O=NH4HCO3;
②NH4HCO3+NaCl=NaHCO3+NH4Cl;③2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
(1)纯碱属于_____(填“酸”“碱”或“盐”)。
(2)有人认为“联合制碱法”有以下优点,正确的是_____。
A生产过程中部分产物可作为原料使用
B副产品是一种氮肥
C反应均不需要加热,可节约能源
(3)第②步反应中加入的是磨细的食盐粉,将食盐磨细的目的是_____。
(4)25℃时,将a g碳酸钠溶解于50g水中恰好形成饱和溶液。所得溶液的溶质质量分数为_____,此温度下碳酸钠的溶解度为_____g(用含a的代数式表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们从山上采集到一种石灰石样品,为了测定石灰石样品中碳酸钙的质量分数(石灰石中的杂质不与盐酸反应,也不溶于水),取45g石灰石样品,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示,请计算:

(1)45g这种石灰石样品中碳酸钙的质量是_____g
(2)本实验是否可以用稀硫酸代替稀盐酸完成实验,并说明理由_____。
(3)列式计算45g石灰石与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数?_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶液在生产和科研中具有广泛的用途,与人们的生活密不可分。
(1)衣服上沾有的油污,可用汽油洗去,是因为汽油能_____ (填“溶解”或“乳化”)油污。
(2)喝了冰镇汽水以后,常常会打嗝。这种现象说明气体的溶解度与_____有关。
(3)某固体物质的溶解度曲线如图所示:
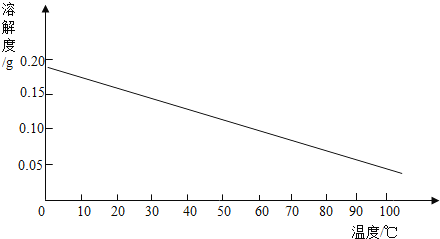
20℃时,要使接近饱和的该物质的溶液变为饱和溶液,通常可采用三种方法,它们分别是_____、_____、_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图中A、B、C、D、E、F分别是铁、水、稀盐酸、稀硫酸、氢氧化钙溶液、硝酸银溶液中的一种,其中A为单质,C和E的物质类别相同。图中用“﹣”或“⌒”表示两种物质之间能发生化学反应,用“→”或“![]() ”表示一种物质可以转化为另一种物质(部分反应物和生成物及反应条件已略去)。请回答下列问题:
”表示一种物质可以转化为另一种物质(部分反应物和生成物及反应条件已略去)。请回答下列问题:
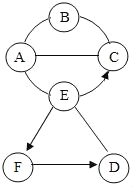
(1)写出C、E物质(或溶质)的化学式:C_____,E_____。
(2)A﹣B反应的化学方程式为_____;F→D反应的化学方程式为_____,该反应的基本类型为_____。
(3)写出A与C发生反应的实验现象:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定标有质量分数为32%的盐酸的实际质量分数,小明实验时先在烧杯中加入20 g 40%的氢氧化钠溶液,再逐滴加入该盐酸,测定出加入盐酸的质量与烧杯中溶液pH的关系如图。
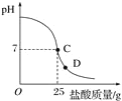
(1)所用氢氧化钠溶液中溶质的质量为_____g。
(2)请认真看清上图信息后回答以下问题。
①当滴加盐酸到C点时,所消耗的盐酸中溶质的质量是多少?_____。
②该盐酸的实际质量分数是多少?(保留到0.1%)_____。
③导致盐酸溶液的溶质质量分数改变的原因是_____。
④当滴加盐酸到图像中D点时,烧杯中溶液的溶质是_____(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com