
【题目】我国著名化学家侯德榜发明的“联合制碱法”的反应原理用化学方程式可简要表示为:①NH3+CO2+H2O=NH4HCO3;
②NH4HCO3+NaCl=NaHCO3+NH4Cl;③2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
(1)纯碱属于_____(填“酸”“碱”或“盐”)。
(2)有人认为“联合制碱法”有以下优点,正确的是_____。
A生产过程中部分产物可作为原料使用
B副产品是一种氮肥
C反应均不需要加热,可节约能源
(3)第②步反应中加入的是磨细的食盐粉,将食盐磨细的目的是_____。
(4)25℃时,将a g碳酸钠溶解于50g水中恰好形成饱和溶液。所得溶液的溶质质量分数为_____,此温度下碳酸钠的溶解度为_____g(用含a的代数式表示)。
【答案】盐 AB 加快反应速度,并使食盐反应充分 ![]() 2a
2a
【解析】
(1)纯碱是碳酸钠的俗称,是由钠离子与碳酸根离子构成的化合物,属于盐;故填:盐;
(2)由以上三个反应可知,水和二氧化碳等物质可以循环使用,制取纯碱时同时生成NH4Cl,NH4Cl是一种氮肥,而2NaHCO3![]() Na2CO3+H2O+CO2↑反应是需要加热的,故选:AB;
Na2CO3+H2O+CO2↑反应是需要加热的,故选:AB;
(3)因增大反应物的接触面积可以加快反应速率,则反应中加入的磨细的食盐粉,能使其充分反应且反应速率加快,故填:加快反应速度,并使食盐反应充分;
(4)25℃时,将a g碳酸钠溶解于50g水中恰好形成饱和溶液。所得溶液的溶质质量分数为![]() ;由溶解度的定义可知,某温度下,100g水中最多溶解的溶质质量即是此物质该温时的溶解度,题目水为50g,溶解的溶质质量为ag,且恰饱和,故此温度下的100g水中最多能溶解2ag碳酸钠达到饱和,即此时其溶解度为2ag;
;由溶解度的定义可知,某温度下,100g水中最多溶解的溶质质量即是此物质该温时的溶解度,题目水为50g,溶解的溶质质量为ag,且恰饱和,故此温度下的100g水中最多能溶解2ag碳酸钠达到饱和,即此时其溶解度为2ag;
故填: ![]() ;2a。
;2a。


科目:初中化学 来源: 题型:
【题目】溶液在生产和科研中具有广泛的用途,与人们的生活密不可分。
(1)衣服上沾有的油污,可用汽油洗去,是因为汽油能_____ (填“溶解”或“乳化”)油污。
(2)喝了冰镇汽水以后,常常会打嗝。这种现象说明气体的溶解度与_____有关。
(3)某固体物质的溶解度曲线如图所示:
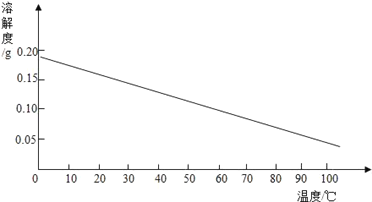
20℃时,要使接近饱和的该物质的溶液变为饱和溶液,通常可采用三种方法,它们分别是_____、_____、_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】完成下列计算(除不尽的数据,保留小数点后两位数据):
(1)乙二酸(HOOC﹣COOH)中O元素的质量分数为_____.
(2)t℃下,将20gNaCl投入80g水,充分搅拌,刚好形成了饱和溶液,如果在t℃下继续向上述溶液中投入20gNaCl并充分搅拌,则所得溶液的溶质质量分数为_____.
(3)某同学为了测定双氧水中溶质的质量分数,用烧杯取双氧水溶液50克,加入二氧化锰1克,完全反应后,称得烧杯内剩余物的总质量为49.4克.则该双氧水中的溶质质量分数是___?(写出解题过程).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有初中阶段常见的A、B、C、D、E、F、G等七种物质。A为白色固体,加热后放出无色气体B并产生白色固体H;C为黑色固体,它在B中燃烧发出白光,生成气体E;E能使澄清的石灰水浑浊;固体D暴露在空气中会发生自燃,生成另一种白色固体G;气体F可由一种淡黄色固体在B中燃烧产生,它能污染空气。试推断上述七种物质,写出其中某些物质的名称:
(1)A______、B______、E______、F______、G______、H______。
(2)写出下列方程式:A→B+H______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应。例如:C+O2![]() CO2,反应前后,碳元素和氧元素的化合价发生了变化,该反应是氧化还原反应。
CO2,反应前后,碳元素和氧元素的化合价发生了变化,该反应是氧化还原反应。
(1)根据化合价是否变化分析,下列反应属于氧化还原反应的是_____(填序号)。
A 2Mg+O2![]() 2MgO B CaO+H2O=Ca(OH)2
2MgO B CaO+H2O=Ca(OH)2
C 2KClO3![]() 2KCl+3O2↑ D CaCO3
2KCl+3O2↑ D CaCO3![]() CaO+CO2↑
CaO+CO2↑
E Zn+H2SO4=ZnSO4+H2↑ F HCl+NaOH=NaCl+H2O
(2)有人说四种基本化学反应类型中复分解反应一定不属于氧化还原反应。你认为这种观点正确吗?为什么?_____。
(3)向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定量的锌粉充分反应后,过滤,得到的滤渣为混合物,则滤液中的溶质可能有_____种组合。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2018年5月13日,我国首艘001A型国产航母开始海试,标志着我国在航海及军事领域取得重大突破。根据所学知识填空。
(1)建造航母用到了钛合金,构成金属钛的粒子是________(填“原子”“分子”或“离子”),工业制钛有一种反应为:TiF4+2H2SO4![]() 4HF+2X+TiO2,X 的化学式为_______。
4HF+2X+TiO2,X 的化学式为_______。
(2)航母外壳用涂料覆盖,是为了防止钢铁材料与_______________接触而锈蚀。
(3)为了探究航母材料中锌、铁、铜三种金属活动性强弱,某同学设计了下列实验(每步均充分反应),其中能达到目的是________________(填序号)。
A.稀盐酸中加入足量铁粉后,再加铜粉,最后加入锌粉
B.ZnCl2溶液中加入足量铁粉后,再加入CuCl2溶液
C.ZnCl2溶液中加入足量铜粉后,再加入铁粉
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对比实验是重要的探究方法,下列关于实验的说法正确的是( )
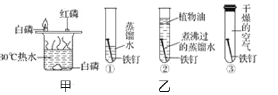
A. 甲可探究燃烧物燃烧是否需要氧气、温度是否要达到着火点
B. 甲实验中水中白磷不燃烧是因为未接触氧气
C. 乙可探究铁生锈是否与空气中的氧气、水都有关系
D. 乙实验中①②对比可探究铁生锈是否与水有关
查看答案和解析>>
科目:初中化学 来源: 题型:
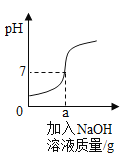
【题目】用溶质质量分数为5%的NaOH溶液中和73g的稀盐酸,反应过程中溶液的酸碱度变化如图所示。请计算
(1)用质量分数为10%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水_____克。
(2)当a为80g时,所得溶液中溶质的质量分数是多少____________(结果精确到0.1%)?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定工业铁红中铁的质量分数,某兴趣小组的同学取10.0g该铁红样品进行了如下的实验。实验所用气体为草酸晶体受热分解制得,化学方程式为: H2C2O43H2O ![]() CO2↑+ CO↑+ 4 H2 O
CO2↑+ CO↑+ 4 H2 O
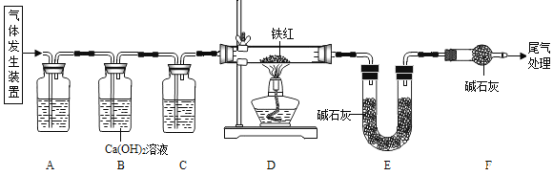
(1)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是_______(填字母编号)
a 浓硫酸 b 澄清石灰水 c 氢氧化钠溶液
(2)B装置的作用是____________ 。
(3)为了实验的安全性和准确性,对D装置加热前和停止加热后,都要________ 。
(4)写出D装置中发生化学反应方程式_____________ (只写一个)。
(5)若D中反应完全进行,且实验前后称得E装置增重6.6g,则此铁红中铁的质量分数为_________ 。
(6)本实验如果缺少装置C(不考虑其它因素),则测得样品中铁的质量分数会______(填“偏小”、“偏大”或者“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com