
【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定工业铁红中铁的质量分数,某兴趣小组的同学取10.0g该铁红样品进行了如下的实验。实验所用气体为草酸晶体受热分解制得,化学方程式为: H2C2O43H2O ![]() CO2↑+ CO↑+ 4 H2 O
CO2↑+ CO↑+ 4 H2 O
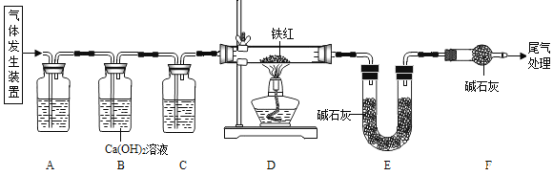
(1)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是_______(填字母编号)
a 浓硫酸 b 澄清石灰水 c 氢氧化钠溶液
(2)B装置的作用是____________ 。
(3)为了实验的安全性和准确性,对D装置加热前和停止加热后,都要________ 。
(4)写出D装置中发生化学反应方程式_____________ (只写一个)。
(5)若D中反应完全进行,且实验前后称得E装置增重6.6g,则此铁红中铁的质量分数为_________ 。
(6)本实验如果缺少装置C(不考虑其它因素),则测得样品中铁的质量分数会______(填“偏小”、“偏大”或者“不变”)。
【答案】c、a 检验CO2是否被吸收完全 持续通入CO气体 Fe2O3 + 3CO![]() 2Fe + 3CO2 或Fe3O4 + 4CO
2Fe + 3CO2 或Fe3O4 + 4CO ![]() 3Fe + 4CO2或FeO + CO
3Fe + 4CO2或FeO + CO![]() Fe + CO2 76% 偏小
Fe + CO2 76% 偏小
【解析】
(1)装置A用来吸收气体中的二氧化碳,应选用氢氧化钠溶液,即c,装置C用来干燥气体,应选用浓硫酸,即a,故填c、a。
(2)装置B中的氢氧化钙溶液能与二氧化碳反应生成碳酸钙沉淀使液体变浑浊,可以检验二氧化碳是否被完全吸收,故填检验CO2是否被吸收完全。
(3)实验开始时,先给D装置通入一氧化碳气体,防止管内气体发生爆炸,实验结束后,应继续通入一氧化碳气体,防止生成的铁重新被氧化,所以对D装置加热前和停止加热后,都要持续通入CO气体,故填持续通入CO气体。
(4)装置D中的化学反应有:氧化铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,四氧化三铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,氧化亚铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,反应的化学方程式依次是Fe2O3 + 3CO![]() 2Fe + 3CO2、Fe3O4 + 4CO
2Fe + 3CO2、Fe3O4 + 4CO ![]() 3Fe + 4CO2、FeO + CO
3Fe + 4CO2、FeO + CO![]() Fe + CO2,故填Fe2O3 + 3CO
Fe + CO2,故填Fe2O3 + 3CO![]() 2Fe + 3CO2( 或Fe3O4 + 4CO
2Fe + 3CO2( 或Fe3O4 + 4CO ![]() 3Fe + 4CO2或FeO + CO
3Fe + 4CO2或FeO + CO![]() Fe + CO2)。
Fe + CO2)。
(5)解:E装置增重6.6g,说明D装置中生成的二氧化碳的质量为6.6g
则样品中氧元素的质量为6.6g×![]() ×100%×
×100%×![]() =2.4g
=2.4g
所以此铁红中铁的质量分数为![]() ×100%=76%,故填76%。
×100%=76%,故填76%。
(6)如果缺少装置C,E装置中的碱石灰会吸收原气体中的水分,E装置增重会偏大,求算出样品中氧元素的质量偏大,则计算出样品中铁元素的质量分数会偏小,故填偏小。
![]()


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】我国著名化学家侯德榜发明的“联合制碱法”的反应原理用化学方程式可简要表示为:①NH3+CO2+H2O=NH4HCO3;
②NH4HCO3+NaCl=NaHCO3+NH4Cl;③2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
(1)纯碱属于_____(填“酸”“碱”或“盐”)。
(2)有人认为“联合制碱法”有以下优点,正确的是_____。
A生产过程中部分产物可作为原料使用
B副产品是一种氮肥
C反应均不需要加热,可节约能源
(3)第②步反应中加入的是磨细的食盐粉,将食盐磨细的目的是_____。
(4)25℃时,将a g碳酸钠溶解于50g水中恰好形成饱和溶液。所得溶液的溶质质量分数为_____,此温度下碳酸钠的溶解度为_____g(用含a的代数式表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常用分解高锰酸钾来制取氧气。
(1)写出高锰酸钾制氧气的化学方程式:_________________________________。
(2)本次实验要用排水法收集2瓶200 mL的氧气(其中一瓶存留少量水)和向上排空气法收集1瓶100 mL的氧气。
①氧气能用排水法收集的理由是_________________________。
②若实验时氧气的密度按1.35g·L–1计,则取用________(选填字母)的高锰酸钾比较适宜(设每药匙约取用2g高锰酸钾)。
A. 2药匙 B. 4药匙 C. 6药匙 D. 8药匙
(3)检查装置的气密性为良好后,向大试管中加入高锰酸钾粉末,使其______________,并________,然后按课本第35页图2–8所示组装实验装置。组装过程中要根据____________的高度,将气体发生装置固定在铁架台的合适位置上。
(4)先_________,再加热试管(要先预热),当_____________时,开始用排水法收集气体。
(5)用向上排空气法收集氧气时,当观察到____________时,移出导管,熄灭酒精灯。
(6)用收集到的3瓶氧气分别做细铁丝、木炭和小蜡烛的燃烧实验。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(9分)某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数.
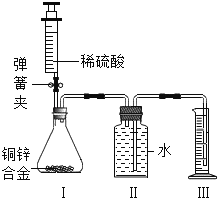
探究过程如下:
①连接实验装置并检查装置气密性.
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL.(注:样品中的杂质不参加反应)
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量1.4g.
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数.
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09g/L.
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为 ,实验过程中须加入稀硫酸至不再产生气体,目的是 .
(2)步骤③中称量剩余固体之前的正确操作是 、洗涤、干燥.
(3)根据实验测定的数据,上述三位同学中 (填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数.
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差.以下因素可能造成偏差的有 (填标号).
A.移出装置Ⅲ时,导管内留存了一部分水
B.实验测量前,没有排除装置Ⅰ中的空气
C.数据处理时,未排除加入稀硫酸所占的体积.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,A~I为初中化学中常见的物质。已知A为金属氧化物,C为大理石的主要成分,D为蓝色沉淀,E、H为单质,F为浅绿色溶液,G、I均为各含有一种溶质的溶液。“→”表示物质间存在着相互转化的关系(部分生成物未标出),如图所示。请回答下列问题:
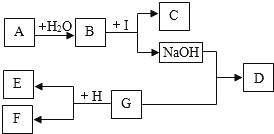
(1)物质D的化学式:_____。
(2)写出A与H2O反应的化学方程式:_____。
(3)写出G与H反应的化学方程式:_____;反应类型属于_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定标有质量分数为32%的盐酸的实际质量分数,小明实验时先在烧杯中加入20 g 40%的氢氧化钠溶液,再逐滴加入该盐酸,测定出加入盐酸的质量与烧杯中溶液pH的关系如图。
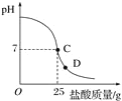
(1)所用氢氧化钠溶液中溶质的质量为_____g。
(2)请认真看清上图信息后回答以下问题。
①当滴加盐酸到C点时,所消耗的盐酸中溶质的质量是多少?_____。
②该盐酸的实际质量分数是多少?(保留到0.1%)_____。
③导致盐酸溶液的溶质质量分数改变的原因是_____。
④当滴加盐酸到图像中D点时,烧杯中溶液的溶质是_____(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】模型是联系宏观与微观的桥梁。
(1)如图是钠原子结构示意图。
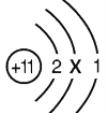
①X的数值为_________________。
②“11”指的是_________________。
③钠原子在化学反应中易失去1个电子,形成_______(填离子符号)。
(2)下图是氢分子和氧分子运动的示意图。

①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是__________(填标号)。
②从图中可见,影响分子运动速率的因素除温度外,还与______________________有关。
③举一个能说明“温度升高,分子运动速率加快”的生活事例:___________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】糖类(按C6H12O6计)在发酵时反应生成乙醇和二氧化碳,其化学反应方程式为:C6H12O6=2C2H5OH+2CO2↑,生活中l°的酒是指:1体积乙醇和99体积水的混合溶液,问:
(1)质量分数为____的糖类溶液发酵能得1°的酒;(水和乙醇的密度分别为1.0g/cm3和0.8g/cm3)(结果保留一位小数)
(2)酿酒厂生产白酒时,常加入适量的一种稀酸溶液来控制酸度,发酵完成后进行蒸馏,即可得到白酒.根据所学化学知识,你认为应加入____溶液来控制酸度,原因是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组对粗盐进行提纯,并配制NaCl溶液。实验流程如下图:
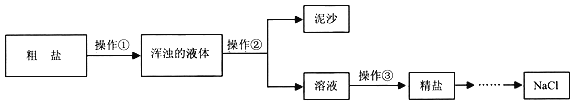
(1)操作③的名称是_________。
(2)操作①②③都要用到的一种玻璃仪器是______,在操作②中,这种玻璃仪器的作用是_____
(3)计算精盐的产率,结果偏低,可能的原因是______(写一种)。
(4)配制100g6%的NaCl溶液,若实际配得的溶液溶质质量分数偏大,可能的原因是____(填标号)。
a 称量NaCl所用天平砝码已生锈 b 用量筒取水时俯视读数
c 用量筒取水时仰视读数 d 用残留蒸馏水的烧杯配制溶液
(5)欲配制20g质量分数为3%的NaCl溶液,需要6%的NaCl溶液________mL(假设NaCl溶液的密度均为1.0g·cm-3)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com