
| A. | 分子质量很小 | B. | 分子间有间隔 | C. | 分子体积很小 | D. | 分子在不断运动 |
分析 根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种的分子性质相同,不同种的分子性质不同,可以简记为:“两小运间,同同不不”,结合事实进行分析判断即可.
解答 解:“满架蔷薇一院香”,是因为蔷薇花香中含有的分子是在不断的运动的,向四周扩散,使人们闻到蔷薇花香.
A、由分子的性质可知,闻到花香的主要原因与分子的质量大小无关,故选项错误.
B、由分子的性质可知,闻到花香的主要原因与分子之间有间隔无关,故选项错误.
C、由分子的性质可知,闻到花香的主要原因与分子的体积大小无关,故选项错误.
D、由于分子是在不断的运动的,这是造成闻到花香的主要原因,故选项正确.
故选:D.
点评 本题难度不大,掌握分子的基本性质及利用分子的基本性质分析和解决问题的方法是解答此类题的关键.


科目:初中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ①②④ | D. | ②③⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 均一、稳定、透明的混合物 | |
| B. | 只有一种溶质和一种溶剂混合而成 | |
| C. | 一种固体溶解在另一种固体中形成的 | |
| D. | 少量氯化钠固体投入水中形成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
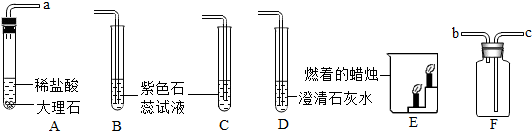
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
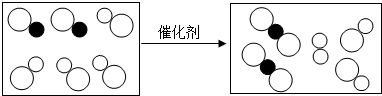
| A. | 反应中可能涉及四种氧化物 | B. | 该反应是分解反应 | ||
| C. | 反应中反应物的分子个数比为1:1 | D. | 生成物有三种 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 40% | B. | 50% | C. | 60% | D. | 70% |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
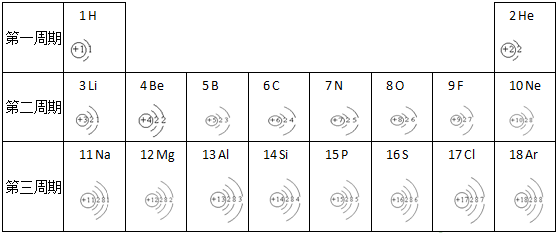
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com