
【题目】某校课外兴趣小组同学对有关镁与盐酸反应的系列研究:
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)实验时需将镁条进行打磨,其目的是_____。
(2)反应中试管外壁发烫,说明镁与稀盐酸反应是_____反应,化学方程式为_____。
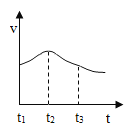
(3)实验 测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则 t1~t2 时间 内反应速率逐渐加快的主要原因是_____。
研究二:探究反应后所得溶液的酸碱性
(发现问题]
(1)反应后甲同学用 pH 试纸测定试管中溶液的酸碱性,发现 pH 小于 7。
(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,振荡显红色, 对此现象,乙同学重复如上实验,得到同样结果。
(提出猜想)甲同学:猜想Ⅰ:稀盐酸过量,使溶液 pH 小于 7;
猜想Ⅱ:氯化镁溶液 pH 小于 7. 乙同学:猜想Ⅰ:氯化镁溶液使酚酞变红色;
猜想Ⅱ:镁与热水反应使酚酞溶液变红色
(实践与思考)为验证猜想,甲乙两同学均需进行一个探究实验是_____. 乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很 快变为红色,同时还观察到镁条表面有气体生成.该气体能燃烧请你根据实验现象写 出镁与水反应的化学反应方程式_____。
(结论)(1)镁与稀盐酸反应,镁反应完全后所得溶液显酸性;
(2)镁与稀盐酸反应,镁过量时所得溶液显碱性
(交流与反思)氯化钠溶液呈中性,而上述甲同学实验中镁完全反应后所得溶液显酸 性,你认为与溶液中_____(填离子符号)。
一段时间后,乙同学观察到溶液红色逐渐变淡,最后消失,你认为原因可能是_____ 请设计实验验证你的猜想_____。
【答案】除去金属表面的氧化物(或污渍),防止干扰实验 放热 Mg+2HCl=MgCl2+H2↑ 镁与稀盐酸反应放热,溶液温度升高,化学反应速率变快 测定氯化镁溶液的酸碱性 Mg+2H2O=Mg(OH)2+H2↑ H+ 氢氧化镁的溶解度随着温度的降低而减小 取适量氢氧化镁固试管中,加入适量蒸馏水,滴入适量酚酞溶液,此时溶液为无色,用酒精灯加热试管,试管中的氢氧化镁固体逐渐溶解,溶液变为红;停止加热后,待试管冷却,观察到溶液中有固体析出,且溶液红色逐渐变淡
【解析】
探究一:(1)实验时需将镁条进行打磨,其目的是:除去金属表面的氧化物(或污渍),防止干扰实验;
(2)反应中试管外壁发烫,说明镁与稀盐酸反应是放热反应,镁与稀盐酸反应产生氯化镁和氢气化学方程式为Mg+2HCl=MgCl2+H2↑。
(3)实验 测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则 t1~t2 时间内反应速率逐渐加快的主要原因是:镁与稀盐酸反应放热,溶液温度升高,化学反应速率变快;
探究二:为验证猜想,甲乙对氯化镁溶液的酸碱性有争议,两同学均需进行一个探究实验是:测定氯化镁溶液的酸碱性; 乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很 快变为红色,说明溶液显碱性,同时还观察到镁条表面有气体生成.该气体能燃烧,该气体是氢气,则镁与热水反应产生氢氧化镁和氢气的化学反应方程式:Mg+2H2O=Mg(OH)2+H2↑
交流与反思:氯化钠溶液呈中性,而上述甲同学实验中镁完全反应后所得溶液显酸性,因为盐酸过量,与溶液中氢离子(H+)有关。
一段时间后,乙同学观察到溶液红色逐渐变淡,最后消失,原因可能是:氢氧化镁的溶解度随着温度的降低而减小,温度降低后,氢氧化镁固体析出,溶液的碱性变弱,红色变淡;
计实验验:取适量氢氧化镁固试管中,加入适量蒸馏水,滴入适量酚酞溶液,此时溶液为无色,用酒精灯加热试管,试管中的氢氧化镁固体逐渐溶解,溶液变为红;停止加热后,待试管冷却,观察到溶液中有固体析出,且溶液红色逐渐变淡。


科目:初中化学 来源: 题型:
【题目】我国在2000年底已探明稀土资源量超过10000万吨,科技部近期出台在“十二五规划”期间资金扶持政策,建立稀有金属战略储备制度,积极调整稀有金属的出口政策,将我国打造成稀有金属研发、生产与应用科技大国。则回答:
(1)稀土元素包括镧(La)与钇(Y)等17种金属元素,被称作当代的“工业味精”。镧、钇两种稀土元素的本质区别在于_____不同。萤石含有微量的稀土元素,经日光照射后可持续发光数十小时,民间称之为“夜明珠”。萤石的主要成分氟化钙(CaF2)中氟元素的化合价为_____。
(2)稀土金属镧(La)和镍形成的镧镍合金是一种优良性能的储氢材料,用于解决氢气的储存和运输困难问题。储氢的原理是储氢材料大量吸收H2,并与H2结合成金属氢化物,此过程发生了____变化(填“物理”、“化学” ),储氢合金属于___ (填“纯净物”、“混合物”),在熔点和硬度等物理性质上与纯金属比较的特点是_________________。
(3)工业上常用金属热还原法制备稀土元素。氯化铈CeCl3在高温条件下与足量的镁发生反应生成稀土元素铈,则发生的化学方程式为____________,该反应属于化学反应的基本类型为__________。
(4)稀土金属矿物的储量有限,而且不能再生。中国稀土资源储藏量占有全世界总量的30%,同样需要绿色生产开发。下列几种做法中,可有效保护稀土金属资源的是_____(填序号)
a回收利用废旧金属制品 b任意开采稀有金属矿石
c加大出口配额,创收外汇 d寻找、开发金属的代用品
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(4分)KNO3和KCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
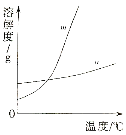
(1)依据上表数据,绘制KNO3和KCl的溶解度曲线,右图中能表示KNO3溶解度曲线的是 。(填m或n)
(2)由表中数据分析可知, KNO3和KCl在某一温度时具有相同的溶解度x,则x的取值范围是 。
(3)10℃时,131g 饱和KCl溶液,蒸发10g水后,再降温到10
(4)如右图所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出。加入的物质可能是下列中的________(填字母序号)。
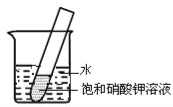
A.氢氧化钠固体 B.生石灰固体
C.冰块 D.硝酸铵固体
E.浓硫酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,添加稀盐酸的质量与产生气体质量的关系如图所示,求:
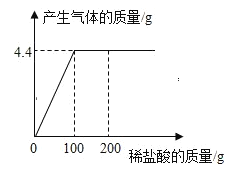
(1)混合物中CaCO3中的质量分数____;
(2)稀盐酸中的溶质质量分数____;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数?____(写出计算过程,计算结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】配平下列化学方程式
(1)_____Fe +___CuSO4 =___Cu +___FeSO4
(2)_____Al(OH)3+___H2SO4=___Al2(SO4)3+___H2O
(3)_____C3H8 +___O2 =___CO2 +___H2O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用下图装置制取二氧化碳并进行性质实验。

(1)锥形瓶中发生反应的化学方程式为______。
(2)甲中CO2验满的方法为______。
(3)乙中a、c为湿润的紫色石蕊试纸,b、d为干燥的紫色石蕊试纸。能说明CO2密度大于空气且能与水反应的现象是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】据报道,中国科学技术大学研究人员利用钴及其氧化物成功研制出一种新型催化剂,可将二氧化碳高效“清洁”地转化成液体染料,反应的微观示意图如下。有关该反应的说法正确的是( )
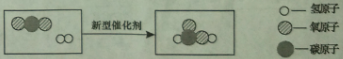
A.反应前后原子总数减少
B.反应物和生成物中共有两种氧化物
C.得到的液体燃料化学式是H2C2O
D.可用于减少温室气体的排放
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下图是元素周期表的一部分,我们对它们进行研究。
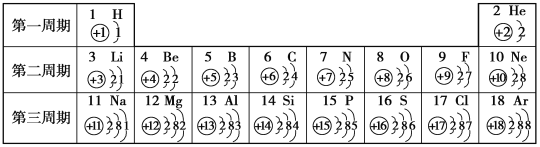
(1)第16号元素位于第_________周期,属于________(填“金属”或“非金属”)元素,它在化学反应中容易_______(填“得”或“失”)电子。
(2)科学家宣布,现已人工合成了第120号元素,则此元素的核电荷数为_____________。
(3)元素周期表中不同种元素最本质的区别是_____________。
(4)在上图中,与铍元素化学性质相似的元素为______________(写出元素符号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】质量相等的两份氯酸钾a和b,a中再加少量二氧化锰,b中再加入少量高锰酸钾,将药品分别加热到完全反应,则收集到氧气的质量随加热时间变化的图象如下,其中相对正确的是( )
A.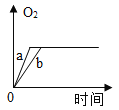 B.
B.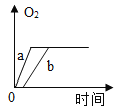 C.
C.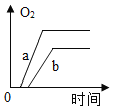 D.
D.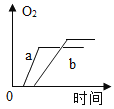
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com