
分析 原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.
分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字.
钾属于金属单质,直接用元素符号表示其化学式.
干冰是固态的二氧化碳,写出其化学式即可.
离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.
化合物化学式的读法:一般是从右向左读,读作“某化某”,化学式中的下标表示构成这个分子的原子个数,有时不用读,有时为了区分不同价态的同种元素组成的化合物,需要读出化学式中的下角标,如SO2、P2O5等;据此进行分析解答.
解答 解:(1)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故3个铁原子表示为:3Fe.
(2)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则2个氧气分子可表示为:2O2.
(3)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故2个氮原子表示为:2N.
(4)钾属于金属单质,直接用元素符号表示其化学式,其化学式为:K.
(5)干冰是固态的二氧化碳,其化学式为:CO2.
(6)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.氯离子可表示为Cl-.
(7)FeSO4中铁元素显+2价,从右向左读,读作硫酸亚铁.
(8)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故3K可表示3个钾原子.
故答案为:(1)3Fe;(2)2O2;(3)2N;(4)K;(5)CO2;(6)Cl-;(7)硫酸亚铁;(8)3个钾原子.
点评 本题难度不大,掌握常见化学用语(原子符号、分子符号、化学式、离子符号等)的书写方法是正确解答此类题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
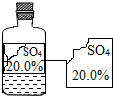 可园学校化学兴趣小组的同学在实验室发现有一瓶无色溶液,由于保管不当,标签残缺不全.下列分析与判断不正确的是( )
可园学校化学兴趣小组的同学在实验室发现有一瓶无色溶液,由于保管不当,标签残缺不全.下列分析与判断不正确的是( )| A. | 这瓶溶液的PH值一定为7 | B. | 这瓶溶液不可能是硫酸铜溶液 | ||
| C. | 这瓶液体不可能是碱 | D. | 这瓶溶液中不一定含有金属元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂 |
| A | KNO3溶液 | K2CO3 | BaCl2溶液 |
| B | Fe | Cu | 稀盐酸 |
| C | CO2 | HCl | 饱和NaHCO3溶液 |
| D | FeSO4溶液 | CuSO4 | Zn |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
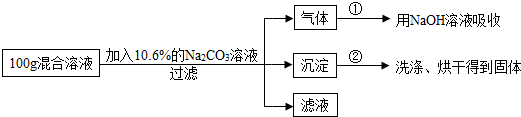
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
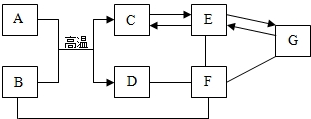 初中几种常见物质间的反应及转化关系如图所示,物质B是一种红色固体粉末,该图体现了化合物F的四种不同化学性质,请依据此图完成下列问题.
初中几种常见物质间的反应及转化关系如图所示,物质B是一种红色固体粉末,该图体现了化合物F的四种不同化学性质,请依据此图完成下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com