
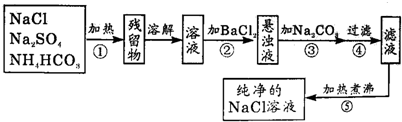
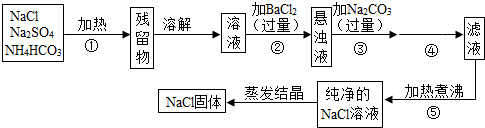
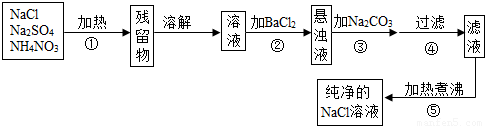
为了将混有硫酸钠、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钠提纯,某同学设计的实验流程如图:
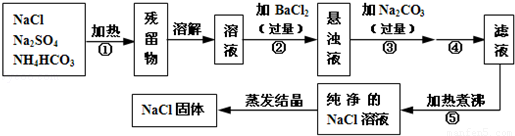 :
:
试回答下列问题:
(1)操作①的目的是 。操作②能否用硝酸钡溶液? (填“能”或“否”)。
(2)进行操作②后,如何判断SO42-已除尽,方法是 。
(3)写出操作③有关的化学反应方程式 。操作④的名称是 。
(4)此设计方案是否严密,说明理由 。
(5)原固体样品中含NaCl m1g,最后得到的NaCl固体m2g,则m1 m2(填“>”、“<”或“=”)。
(1)除去碳酸氢铵;否; (2)静置,往上层澄清液中滴加BaCl2溶液,如果没有白色沉淀产生,则SO42-已除尽(或取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42﹣已除尽);
(3)BaCl2+Na2CO3=BaCO3↓+2NaCl;过滤;
(4)不严密,操作③引入的过量Na2CO3没有除去;(5)<
【解析】
试题分析:该同学采取的方法是:加热混合物,除去碳酸氢铵,加入过量氯化钡溶液除去硫酸钠,再加入过量碳酸钠溶液除去过量的氯化钡,过滤掉生成的硫酸钡、碳酸钡沉淀,并蒸发滤液得到氯化钠固体。
(1)依据题意:碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水),所以操作①加热的目的是除去碳酸氢铵;操作②若加入硝酸钡溶液,硝酸钡和硫酸钠反应生成硫酸钡和硝酸钠,除去了硫酸钠,但引入了硝酸钠新的杂质,故不能用硝酸钡溶液;
(2)加入过量氯化钡溶液除去硫酸根离子,要检验硫酸根离子已除尽,可静止片刻,取少量上层清液,滴加氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽;
(3)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钡反应生成碳酸钡和氯化钠,除去过量的氯化钡,方程式是BaCl2+Na2CO3=BaCO3↓+2NaCl;再过滤去操作②中的硫酸钡和生成的碳酸钡沉淀;
(4)此方案不严密,过量的碳酸钠没有除去,得到的溶液中含有氯化钠和过量的碳酸钠两种溶质,致使得到的氯化钠溶液不纯,应加入适量盐酸除去碳酸钠,再加热煮沸;
(5)因为过量的碳酸钠没有除去,所以蒸发得到的晶体中还含有碳酸钠,所以m1<m2。
考点:考查混合物的分离方法;盐的化学性质


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

| O | 2- 4 |
| O | 2- 4 |
| O | 2- 4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 :
: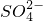 已除尽,方法是______.
已除尽,方法是______.查看答案和解析>>
科目:初中化学 来源:2010年第二十届“天原杯”全国初中学生化学素质和实验能力竞赛(广州赛区)初赛试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com