
【题目】金属结构和性质等是化学研究的重要内容.
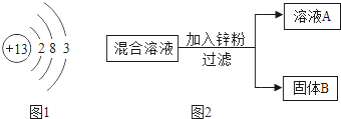
(1)如图1是铝的原子结构示意图.下列说法不正确的是________
A.铝原子的质子数为13
B.化合物中铝元素通常显+3价
C.铝是地壳中含量最多的元素
D.铝可作导线是由于它具有良好的导电性
(2)工业上用CO和赤铁矿石炼铁的化学方程式为________ .
(3)R是银白色金属,将稀盐酸分别加入到盛有金属Fe、R、Cu的试管中,只有Cu表面无现象;将 FeSO4溶液中分别加入到盛有金属R、Cu的试管中,只有R表面有黑色物质析出,则金属H、Fe、R、Cu活动性由强到弱的顺序是________ .
(4)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了如图2所示实验,下列关于溶液A中的溶质不合理的猜想及其理由是________
猜想1:只有Zn(NO3)2
猜想2:Zn (NO3)2、AgNO3
猜想3:Zn (NO3)2、Cu(NO3)2
猜想4:Zn (NO3)2、AgNO3、Cu(NO3)2
若“猜想1”成立,通过实验确定固体B的成分的方案是________
【答案】C;3CO+Fe2O3![]() 2Fe+3CO2;R>Fe>H>Cu;猜想2;猜想②中无硝酸铜,说明Cu(NO3)2已与锌反应生成Cu,而铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银;取少量固体B于试管中,加入足量的稀盐酸(或稀硫酸),若有气泡产生则固体B的成分是Zn、Cu、Ag的混合物,若无气泡产生则固体B的成分是Cu、Ag的混合物
2Fe+3CO2;R>Fe>H>Cu;猜想2;猜想②中无硝酸铜,说明Cu(NO3)2已与锌反应生成Cu,而铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银;取少量固体B于试管中,加入足量的稀盐酸(或稀硫酸),若有气泡产生则固体B的成分是Zn、Cu、Ag的混合物,若无气泡产生则固体B的成分是Cu、Ag的混合物
【解析】
根据原子结构示意图的意义、铝的性质、在地壳中的含量分析,炼铁的原理,金属与酸、盐的反应现象,金属活动顺序表进行分析解答。
(1)A、由铝的原子结构示意图的意义可知,铝原子的质子数为13,故A正确;B、由铝的原子结构示意图的意义可知,铝原子最外层的电子数是3,在反应中常失去3个电子,化合物中铝元素通常显+3价,故B正确;C、铝是地壳中含量最多的金属元素,氧是地壳中含量最多的元素,故C错误;D、铝可作导线是由于它具有良好的导电性,故D正确。故选C;
(2)工业上用CO和赤铁矿石炼铁时,一氧化碳与氧化铁在高温下反应生成铁和二氧化碳,反应的化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(3)由题意可知,将稀盐酸分别加入到盛有金属Fe、R、Cu的试管中,只有Cu表面无现象,说明了Fe、R的活动性大于氢,Cu的活动性小于氢;由将 FeSO4溶液中分别加入到盛有金属R、Cu的试管中,只有R表面有黑色物质析出,说明了R的活动性大于铁,Cu的活动性小于铁,综上所述可知,则金属H、Fe、R、Cu活动性由强到弱的顺序是:R>Fe>H>Cu;
(4)在金属活动性顺序中,锌>铜>银,锌能与硝酸银反应生成银和硝酸锌,锌和硝酸铜反应生成铜和硝酸锌,混合溶液中加入一定量的锌粉,锌先置换出硝酸银中银,再去置换硝酸铜的铜。猜想1:当加入的锌粉时足量时,能将溶液中银、铜的全部置换出来,溶液中只有Zn(NO3)2,故猜想1合理;猜想2:猜想②中无硝酸铜,说明Cu(NO3)2 已与锌反应生成Cu,铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银,也就是说只要有硝酸银时,一定也含有硝酸铜,故猜想②不合理;猜想3:当加入的锌粉时不足量时,只能将溶液中银的全部置换出来,溶液中有Zn(NO3)2、Cu(NO3)2,故猜想3合理;猜想4:当加入的锌粉时较少的,只能将溶液中银的部分置换出来,溶液中有Zn(NO3)2、AgNO3、Cu(NO3)2,故猜想4合理;
由上述分析可知若猜想1成立,锌将硝酸银、硝酸铜完全反应,固体B中一定存在Cu、Ag,可能存在Zn(当Zn过量时),Cu、Ag活动性小于氢,锌的活动性大于氢,锌与酸能发生反应生成氢气,通过实验确定固体B的成分的方案是:取少量固体B于试管中,加入足量的稀盐酸(或稀硫酸),若有气泡产生则固体B的成分是Zn、Cu、Ag的混合物,若无气泡产生则固体B的成分是Cu、Ag的混合物。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
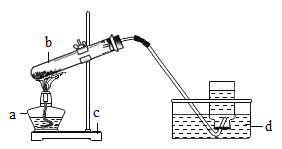
【题目】某校研究性学习小组到实验室进行探究实验。他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质。
请指出图中所用仪器的名称:(1)a________ b________ c________ ;d________ ;
(2)他们所用的装置图中有一些错误,请你为他们指出来:
a.________ ;b.________ ;c.________ ;d.________ ;
(3)收集满氧气后,应用玻璃片盖住集气瓶口,并________ (填“正放”或“倒放”)在桌上。停止加热,熄灭酒精灯前,应该:________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学设计了右图用于制取氢气的装置,根据该
图回答下列问题。
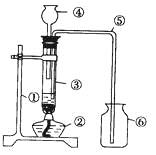
(1)写出有编号的仪器名称:①________②________
③________④________⑤________⑥________
(2)试管中选用的最佳药品是________和________。
(3)指出图中的四处错误,并加以改正:
①________
②________
③________
④________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于碳和碳的化合物知识网络图(图中“→” 表示转化关系)的说法正确的是

A. “C → CO”的反应中碳发生还原反应
B. “CO → CO2”的反应类型为置换反应
C. “CO2 → CaCO3”的反应可用于检验二氧化碳
D. “CO2 ![]() H2CO3”的反应可用酚酞试剂验证
H2CO3”的反应可用酚酞试剂验证
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】超市出现了一种含“污渍爆炸盐”的新产品(如图),能清除衣服上难以清洗的汗 渍、果汁渍。它的特殊的名称让小明对它产生了探究的兴趣。

(1)小明在超市的___区域购买了此产品。
(2)阅读产品标签:“污渍爆炸盐”是一种衣物助洗剂,主要成分是过碳酸钠,能在瞬间去除洗衣液难以除去的多种顽固污 渍……,本产品不伤衣物,无磷是它的一大优点。含磷洗涤剂对环 境的危害是______。
(3)查阅资料:过碳酸钠(Na2CO4)是白色结晶颗粒,溶于水 会产生碳酸盐和其它化合物。
(4)合理猜想其它化合物为:
i. NaOH;ii. H2O2;iii. NaOH 和 H2O2;小明做出以上猜想的理论依据是___。
(5)实验设计:探究“污渍爆炸盐”水溶液的成分,完成下列表格。 已知:Mg(OH)2 是难溶于水的白色固体。
实验步骤 | 实验现象 | 实验结论 |
步骤 1:取少量“污渍爆炸盐”于烧杯中,加入足量蒸馏水,充分搅拌。 | 固体完全溶解,形成无色溶液 | |
步骤 2:取少量步骤 1 形成的溶液于试管中,再加 入___ , 振荡,静置。 | 白色沉淀 | 含有 Na2CO3 |
步骤 3:取少量步骤 2 试管中的上层清液于另一支 试管中,再滴加少量 MgCl2 溶液,振荡。 | 无明显现象 | ___ |
步骤 4:另取一支试管,加入少量步骤 1 形成的溶 液,再加入__ , 将带火星木条伸入试管中。 | ___ | 含有 H2O2 |
(6)实验结论:猜想__ 正确。写出过碳酸钠与水反应的化学方程式:____ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学方程式与事实不相符的是( )
A. 铝在空气中与氧气反应生成一层致密薄膜4Al+3O2=2Al2O3
B. 铜在稀硝酸中逐渐溶解,放出气体,溶液变为蓝色Cu+2HNO3=Cu(NO3)2+H2↑
C. 胃酸过多病症可以服用含氢氧化铝药物进行缓解Al(OH)3+3HCl=AlCl3+3H2O
D. 人体摄入淀粉后能转换为葡萄糖,葡萄糖经缓慢氧化后变成二氧化碳和水C6H12O6+6O2![]() 6CO2+6H2O
6CO2+6H2O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国规定水质必须在感官指标、化学指标、病理学指标等方面达标才能成为饮用水:
(1)感官指标;水应澄清透明.为达到此要求,可以加入明矾使杂质沉降,然后通过________(填操作名称)而实现,要除去其异味则通常需要通过木炭的________作用.
(2)化学指标:含有水硬度项.生活中区分硬水和软水最简便的方法是用________区分.
(3)病理学指标:对细菌的含量有严格的限制.可以通过________操作,既能杀菌,又能得到几乎纯净的水.
学习化学以后,我们对水有了一些新的认识.
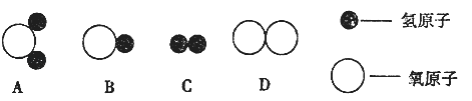
知道了水的微观结构,可用A米表示构成水的粒子.
(4)了解了水的宏观组成,水中氢元素的质量分数是 ________.
(5)认识了水的化学性质,写出下列化学反应方程式:水中通直流电 ________,由此说明水是由________组成的.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某溶液中可能含有碳酸钾、硫酸钾中的一种或两种溶质,为测定其成分,进行如下实验:取一定量溶液于烧杯中,先加入过量氯化钡溶液,再加入稀硝酸,反应过程及产生沉淀的质量与所加溶液质量的关系如图所示。下列说法中正确的个数有( )
①该溶液中一定含有碳酸钾和硫酸钾
②反应进行到a点时,溶液中只含有一种溶质
③bc段上的任意一点 (c点除外) 都存在两种沉淀
④反应进行到c点时,溶液中只含有两种溶质
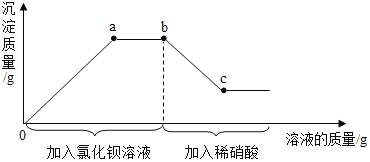
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量的NaCl,加热到一定温度,持续通入SO2,待反应一段时间,过滤得到粗碲。
(1)反应的总反应方程式为TeOSO4 + 2SO2 + 3__X__ ![]() Te↓+ 3H2SO4,则X为_________(填化学式)
Te↓+ 3H2SO4,则X为_________(填化学式)
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
实验 | 温度/℃ | 反应时间/h | 粗碲沉淀率/% |
a | 65 | 3.0 | 65.0 |
b | 80 | 3.0 | 98.9 |
c | 80 | 2.0 | 98.9 |
d | 90 | 2.0 | 97.0 |
①该小组研究的反应条件是_________________和_____________。
②实验a和b的目的是______________________________。
③在上述四组实验中,最佳的反应条件是_______℃和_______h。
④为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率。若再设计对比实验,选择的反应条件还可以是__________(填选项)。
A.80℃,1.5h B.80℃,2.5h C.70℃,2.0h D.95℃,2.0h
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com