
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
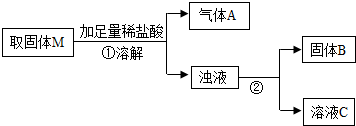
 MgO+Cu.为探究该反应并采用热还原法制取金属铜,他在老师的指导下进行如下实验:将镁粉和氧化铜按一定比例充分混合,隔绝空气加热一段时间后,得到固体M.请你与小辉同学一起对该固体M进行探究.(资料:常温下,镁不与水发生反应;)
MgO+Cu.为探究该反应并采用热还原法制取金属铜,他在老师的指导下进行如下实验:将镁粉和氧化铜按一定比例充分混合,隔绝空气加热一段时间后,得到固体M.请你与小辉同学一起对该固体M进行探究.(资料:常温下,镁不与水发生反应;)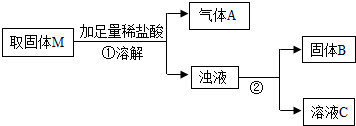
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| ||
查看答案和解析>>
科目:初中化学 来源:2010年江苏省无锡市前洲中学九年级化学反馈练习试卷(解析版) 题型:填空题
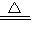 MgO+Cu.为探究该反应并采用热还原法制取金属铜,他在老师的指导下进行如下实验:将镁粉和氧化铜按一定比例充分混合,隔绝空气加热一段时间后,得到固体M.请你与小辉同学一起对该固体M进行探究.(资料:常温下,镁不与水发生反应;)
MgO+Cu.为探究该反应并采用热还原法制取金属铜,他在老师的指导下进行如下实验:将镁粉和氧化铜按一定比例充分混合,隔绝空气加热一段时间后,得到固体M.请你与小辉同学一起对该固体M进行探究.(资料:常温下,镁不与水发生反应;)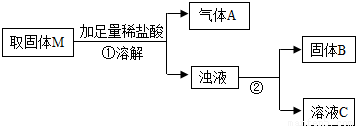
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com