
【题目】下列图像能正确反映所对应叙述关系的是
A.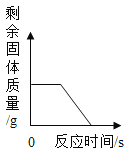 一定量的木炭还原氧化铜,剩余固体质量与反应时间的关系
一定量的木炭还原氧化铜,剩余固体质量与反应时间的关系
B.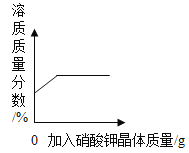 t℃时,向饱和硝酸钾溶液中加入硝酸钾晶体,溶质质量分数与加入硝酸钾质量的关系
t℃时,向饱和硝酸钾溶液中加入硝酸钾晶体,溶质质量分数与加入硝酸钾质量的关系
C.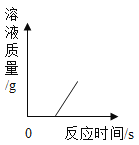 将锌粒加入到一定量的稀硫酸中,溶液的质量与反应时间的关系
将锌粒加入到一定量的稀硫酸中,溶液的质量与反应时间的关系
D.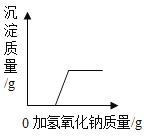 向硫酸和硫酸铜混合溶液中加入氢氧化钠溶液,沉淀质量与加入量的关系
向硫酸和硫酸铜混合溶液中加入氢氧化钠溶液,沉淀质量与加入量的关系
【答案】D
【解析】
A、木炭还原氧化铜生成铜和二氧化碳,方程式为:![]() 。从方程式可知,生成物中含有铜单质,固体的质量一定不为0。A错误;
。从方程式可知,生成物中含有铜单质,固体的质量一定不为0。A错误;
B、一定温度下,饱和的硝酸钾溶液不能继续在溶解硝酸钾了。所以加入的硝酸钾无法继续溶解,溶质质量分数不变。B错误;
C、将锌和稀硫酸混合后,锌和稀硫酸反应生成硫酸锌和氢气,方程式为:![]() 。由此可知,锌和稀硫酸一接触就会反应生成硫酸锌和氢气,溶液的质量逐渐增加,待硫酸消耗尽后,加入的锌粒不会反应,也不会形成溶液,则此时溶液的质量不变。C错误;
。由此可知,锌和稀硫酸一接触就会反应生成硫酸锌和氢气,溶液的质量逐渐增加,待硫酸消耗尽后,加入的锌粒不会反应,也不会形成溶液,则此时溶液的质量不变。C错误;
D、硫酸能与氢氧化钠反应生成硫酸钠和水,硫酸铜能与氢氧化钠反应生成氢氧化铜和硫酸钠。生成的氢氧化铜可以与硫酸反应生成硫酸铜和水,所以有硫酸存在时,硫酸铜不能直接与氢氧化钠反应生成氢氧化铜沉淀,等硫酸被消耗尽此能生成沉淀。D正确。
故选D。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:初中化学 来源: 题型:
【题目】如图是实验室用高锰酸钾制取氧气的仪器装置:
(1)写出其中的三处错误:
a._____;
b._____;
c._____。
(2)实验后发现试管破裂,你认为可能的原因是(答出一种即可):_____。
(3)说出图中仪器的名称:a._____ e._____。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
(查阅资料)
经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为_____。
(对比实验)
编号 | 操作 | 现象 |
甲 | 将表面未打磨的铝丝浸入CuSO4溶液中 | 无明显现象 |
乙 | 将表面打磨后的铝丝浸入CuSO4溶液中 | 铝丝表面析出红色固体 |
丙 | 将表面未打磨的铝丝浸入CuCl2溶液中 | 铝丝表面析出红色固体 |
(1)比较实验乙和实验_____(填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为_____,据此可知金属活动性Al比Cu_____(填“强”或“弱”)。
(3)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是_____。
(猜测与探究)
小组同学针对实验丙的现象,经讨论后猜测:Cl-破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
操作 | 现象 | 结论 | 推论 |
(1)向一支试管中再加入 NaCl固体 | 铝丝表面析 出红色固体 | 氧化铝薄膜 被破坏 | Na+或①_____能 破坏氧化铝薄膜 |
(2)向另一支试管中再加入 Na2SO4固体 | ②_____ | 氧化铝薄膜 未被破坏 | Na+和SO42都不能 破坏氧化铝薄膜 |
(结论与反思)
得出结论:前述猜测_____(填“正确”或“不正确”)。总结反思:本次探究充分运用了比较法和控制变量法。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有下列四套常见的实验装置,请按要求填写下列有关空格:
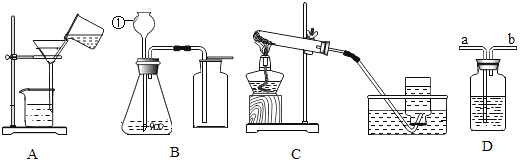
(1)写出B装置中标号仪器的名称:①______;
(2)除去食盐水中的泥沙,选用的装置是______(填序号),完成操作还需要的仪器是______;
(3)高锰酸钾制氧气应选用的C装置,此装置的试管口还需要放一团棉花,作用是______,反应的化学方程式为______;
(4)请写出用装置B制取二氧化碳气体的化学方程式______;如果用D装置干燥生成的二氧化碳,则D中盛放的物质是______;
(5)实验室可用C装置制取甲烷(CH4)气体,由此推断下列说法错误的是______(填序号);
A 制取甲烷的药品是固体B 甲烷在水中溶解性较小
C 甲烷难以与水反应D 甲烷密度大于空气
(6)D装置用途广泛,可用来洗气、贮气等。当用排水集气法收集氢气时,瓶内先装满水,气体从______(填“a”或“b”,下同)处导管通入;若要用水将瓶中氢气排出使用,水应从______处导管进入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙是三种单质,其中乙是气体,丙是常见的黑色固体,A、B、C是三种化合物,它们之间有下列转化关系:
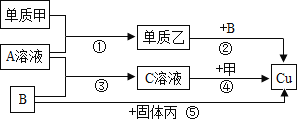
(1)用化学式表示下列物质:B______ 乙______丙______。
(2)写出⑤反应的化学方程式:______;
(3)①至⑤的反应中属于复分解反应的是______(填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】天然气的主要成分是甲烷(CH4)。化学兴趣小组的同学对甲烷燃烧的产物产生了兴趣:
[提出问题]甲烷燃烧后生成哪些物质?
[查阅资料]含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;无水CuSO4遇水变蓝。
[猜想与假设]
甲:CO2、H2O;
乙:CO、H2O;
丙:NH3、CO2、H2O;
丁:CO2、CO、H2O。
你认为_____同学的猜想是错误的,理由是_____。
[实验探究]为了验证上述猜想与假设,将甲烷在一定量的氧气中燃烧的产物依次通过如图所示装置:(假设装置中气体均完全吸收)

(1)A,B装置的顺序能否颠倒?_____ (填“能”或“否”)。
(2)实验中用纯净氧气而不用空气的原因是_____。
(3)实验中观察到A中无水CuSO4变蓝,B,D中澄清石灰水变浑浊,C中红色粉末变成黑色,由此推断_____同学猜想成立。
[反思与交流]为避免CO污染环境,含碳元素的物质燃烧需满足的条件是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
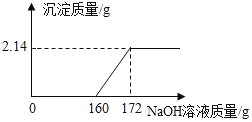
【题目】工业盐酸中通常溶有少量的FeCl3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。请回答下列问题:
(1)FeCl3与NaOH恰好完全反应时,生成沉淀的质量是______g。
(2)该工业盐酸中HCl的质量分数是多少(写出计算过程)______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】中国科学院院士张青莲教授主持测定了铟等元素的相对原子质量的新值,为相对原子质量的测定做出了卓越贡献。铟元素在元素周期表中的某些信息及原子结构示意图如图所示,下列说法不正确的是( )
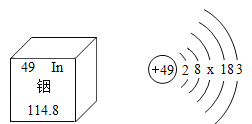
A.铟元素的相对原子质量是 114.8
B.铟原子在化学反应中容易失去电子形成阴离子
C.原子结构示意图中x=18
D.铟原子的质子数是49
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
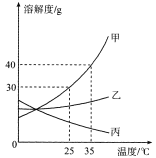
(1)25℃时,将50g甲固体加入到100g水中,充分溶解并恢复到原温度后,得到溶液的质量为 g。
(2)要使35℃时接近饱和的丙溶液变成该温度下的饱和溶液,可采用的一种方法是 。
(3)现有操作步骤:A.溶解、B.过滤、C.降温结晶、D.加热浓缩。若甲固体中含有少量乙,则提纯甲的操作步骤是 。(填字母序号)
(4)若将35℃时甲的饱和溶液降温到25℃,则其溶液的溶质质量分数会 。(填字母序号)
A.变大 B.变小 C.不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com