
| A. | 0.1g | B. | 0.2g | C. | 0.3g | D. | 0.4g |
分析 根据镁、氧化镁与稀盐酸反应的化学方程式中的质量比,先计算出镁的质量,在计算生成氢气的质量.
解答 解:100克14.6%稀盐酸中溶质的质量为;100g×14.6%=14.6g;
设,固体中镁的质量为x,生成氢气质量为y,
Mg+2HCl═MgCl2+H2↑. MgO+2HCl═MgCl2+H2O
24 73 2 40 73
x $\frac{73x}{24}$ y 6.4g-x $\frac{73×(6.4g-x)}{40}$
由题意可知:$\frac{73x}{24}+\frac{73×(6.4g-x)}{40}=14.6g$
解得;x=2.4g
则:$\frac{24}{2.4g}=\frac{2}{y}$
y=0.2g
故答案:B.
点评 本题考查学生的转化能力,即根据镁、氧化镁与稀盐酸反应的化学方程式中的质量比来分析计算即可.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 太阳能路灯系统是利用太阳能进行照明的装置,被越来越广泛地应用.它是由太阳能电池板、蓄电池、LED灯、灯柱、微电脑控制器这五大部分组成.
太阳能路灯系统是利用太阳能进行照明的装置,被越来越广泛地应用.它是由太阳能电池板、蓄电池、LED灯、灯柱、微电脑控制器这五大部分组成.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①③④ | C. | ①②⑤⑥ | D. | ①②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
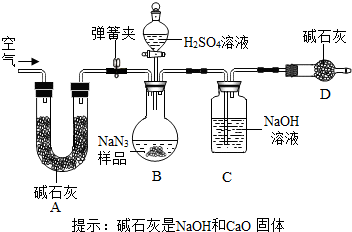 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe | B. | H2SO4 | C. | H2 | D. | FeSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com