
分析 (一)(1)根据铁和硫酸铜反应生成硫酸亚铁和铜进行分析;
(2)根据材料的分类解答;
(3)根据胃酸的主要成分是盐酸,盐酸和铁反应会生成氯化亚铁和氢气进行分析;
(二)(1)根据铁生锈的条件进行解答;
(2)根据铁与水和氧气作用下生成氢氧化亚铁进行分析;
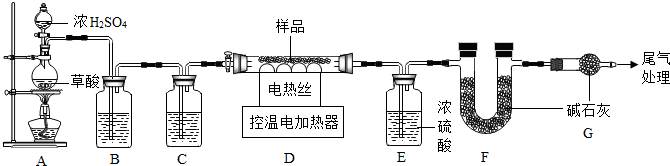
(3)①根据有气体参加或生成的反应,组装好仪器后,要先检验装置气密性,再装药品进行反应;
②根据草酸分解生成水、二氧化碳、一氧化碳,在一氧化碳参与反应之前,需要先将二氧化碳和水除去进行分析;
③根据浓硫酸有吸水性,碱石灰会与二氧化碳反应进行分析;
④根据空气中的二氧化碳、水会与碱石灰反应进行分析;
(三)(1)根据一氧化碳和氧化铁在高温的条件下反应生成铁和二氧化碳进行分析;
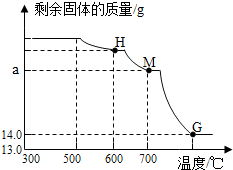
(2)根据碳酸亚铁分解生成氧化亚铁和二氧化碳,一氧化碳还原氧化铁的三个阶段的反应可知,M点实际是一氧化碳将氧化铁还原生成了氧化铁和碳酸亚铁分解生成氧化亚铁的质量之和,结合前面计算出的碳酸亚铁的质量、氧化铁的质量即可求出M点的数值.
解答 解:(一)(1)硫酸铜溶液遇到金属铁时,铁与硫酸铜发生置换反应能生成金属铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;
(2)不锈钢丝属于金属材料,聚乙烯纤维属于合成材料,耐酸防护服材料属于复合材料,故选:B;
(3)胃酸的主要成分是盐酸,盐酸和铁反应会生成氯化亚铁和氢气,化学方程式为:Fe+2HCl═FeCl2+H2↑;
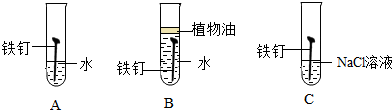
(二)(1)铁生锈时,需要水分和氧气同时存在,当有盐类物质存在时,生锈速度加快,故选:C;
(2)铁与水和氧气作用下生成氢氧化亚铁,化学方程式为:2Fe+O2+2H2O═2Fe(OH)2;
(3)①有气体参加或生成的反应,组装好仪器后,要先检验装置气密性,再装药品进行反应;
②依据质量守恒定律可知,生成物中有氢元素,所以反应物中也必须有氢元素,草酸分解生成水、二氧化碳、一氧化碳,在一氧化碳参与反应之前,需要先将二氧化碳和水除去,浓硫酸有吸水性,氢氧化钠会与二氧化碳反应,要先除二氧化碳,在除水蒸气,所以洗气瓶B中应盛放氢氧化钠溶液,故选:c;
③浓硫酸有吸水性,碱石灰会与二氧化碳反应,加热到了300℃,所以一氧化碳不会还原氧化铁,浓硫酸增加的质量是水的质量,来自铁锈,碱石灰增加的质量来自碳酸亚铁分解生成的二氧化碳,所以依据元素守恒进行计算
设碳酸亚铁的质量为y,
$\frac{12}{116}$×y=$\frac{12}{44}$×2.2g
y=5.8g
所以Fe2O3•xH2O为:25.4g-5.8g=19.6g,氧化铁的质量为:$\frac{160}{196}$×19.6g=16g
$\frac{2x}{160+18x}$×19.6g=$\frac{2}{18}$×3.6g
x=2;
④空气中的二氧化碳、水会与碱石灰反应,导致F装置中收集的二氧化碳质量偏大,所以碳酸亚铁质量偏大,Fe2O3•xH2O,所以x质量偏大;
(三)(1)一氧化碳和氧化铁在高温的条件下反应生成铁和二氧化碳,化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)设碳酸亚铁生成的氧化亚铁质量为a,
FeCO3→FeO
116 72
5.8g a
$\frac{116}{5.8g}$=$\frac{72}{a}$
a=3.6g
氧化铁生成的氧化亚铁质量为b,
Fe2O3→2FeO
160 144
16g b
$\frac{160}{16g}$=$\frac{144}{b}$
b=14.4g
所以M=14.4g+3.6g=18g.
故答案为:
(一)(1)Fe+CuSO4=FeSO4+Cu;
(2)B;
(3)Fe+2HCl═FeCl2+H2↑;
(二)(1)C;
(2)2Fe+O2+2H2O═2Fe(OH)2;
(三)(1)检查装置的气密性;
(2)H,c;
(3)5.8,2;
(4)偏大,偏大;
(三)(1)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)18.
点评 本题考查一氧化碳还原铁的氧化物的步骤、现象、化学反应式的书写,以及用不同的方法验证铁的存在,需要同学们具有比较全面的化学知识.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 0.1g | B. | 0.2g | C. | 0.3g | D. | 0.4g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 为验证混合气体中是否含有CO,CO2,H2O,H2 这四种气体,现有无水硫酸铜,澄清石灰水,浓硫酸,氢氧化钠溶液以及如图所示装置甲.能验证这四种气体的方法正确的是( )
为验证混合气体中是否含有CO,CO2,H2O,H2 这四种气体,现有无水硫酸铜,澄清石灰水,浓硫酸,氢氧化钠溶液以及如图所示装置甲.能验证这四种气体的方法正确的是( )| A. | 依次通入无水硫酸铜,澄清石灰水,浓硫酸,甲装置,无水硫酸铜,澄清石灰水 | |
| B. | 依次通入无水硫酸铜,澄清石灰水,甲装置,无水硫酸铜,澄清石灰水 | |
| C. | 依次通入澄清石灰水,无水硫酸铜,浓硫酸,甲装置,无水硫酸铜,澄清石灰水 | |
| D. | 依次通入无水硫酸铜,澄清石灰水,浓硫酸,甲装置,澄清石灰水,无水硫酸铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 元素周期表是学习化学的重要工具.如表是元素周期表的一部分,请依据此表回答有关问题.
元素周期表是学习化学的重要工具.如表是元素周期表的一部分,请依据此表回答有关问题.| 第一周期 | 1 H 1.008 | 2 He 4.003 | ||||||
| 第二周期 | 3 Li 6.941 | 4 Be 9.012 | 5 B 10.81 | 6 C 12.01 | 7 N 14.01 | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
| 第三周期 | 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com