
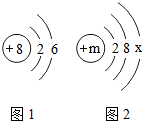
 元素周期表是学习化学的重要工具.如表是元素周期表的一部分,请依据此表回答有关问题.
元素周期表是学习化学的重要工具.如表是元素周期表的一部分,请依据此表回答有关问题.| 第一周期 | 1 H 1.008 | 2 He 4.003 | ||||||
| 第二周期 | 3 Li 6.941 | 4 Be 9.012 | 5 B 10.81 | 6 C 12.01 | 7 N 14.01 | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
| 第三周期 | 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
分析 (1)根据元素周期表的信息以及最外层有8个电子的结构属于稳定结构;
(2)根据最外层电子数决定元素的化学性质以及原子中,核电荷数=质子数=核外电子数来分析;
(3)根据原子序数决定元素种类以及复分解反应的特点来分析.
解答 解:(1)由元素周期表可知,氮元素的相对原子质量为14.01,在第三周期中,氩原子的最外层有8个电子,属于稳定结构,故填:14.01,氩;
(2)该元素与氧元素的化学性质相似,故其最外层有6个电子,即x=6,则m=2+8+6=16;故填:16,6;
(3)1、8、11、12、17分别为氢元素、氧元素、钠元素、镁元素和氯元素,可以为氢氧化钠与稀盐酸的反应、盐酸和氢氧化镁的反应、氢氧化钠与氯化镁的反应,这三个均属于复分解反应.故填:HCl+NaOH=NaCl+H2O(合理即可).
点评 掌握元素周期表的信息以及原子示意图的信息、复分解反应的特点是解题的关键.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
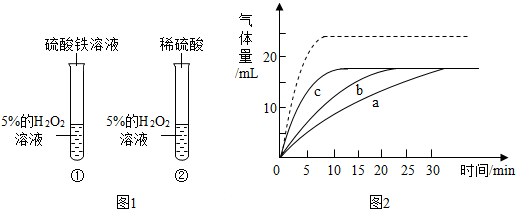
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe | B. | H2SO4 | C. | H2 | D. | FeSO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 有一包白色固体,可能含有BaCl2、KCl、K2SO4、K2CO3中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
有一包白色固体,可能含有BaCl2、KCl、K2SO4、K2CO3中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )| A. | 肯定只存在BaCl2 | B. | 可能存在K2SO4 | C. | 可能存在KCl | D. | 肯定不存在K2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com