
分析 (1)根据原子核的反应包括核裂变和核聚变进行分析;
(2)根据题中所给的数据,内能转化为电能的效率是50%进行分析;
(3)根据碳和氧气反应会生成二氧化碳,结合题中所给的数据进行解答.
解答 解:(1)通过分析可知,氢的同位素氘、氚在可控情况下发生的反应属于核反应中聚变;
(2)要得到1×1012J的电能,需要的热能
1×$\frac{1012J}{50%}$=2×1012J
1升海水中提取的氢同位素,在核反应中释放出的能量相当于
300千克×3×107J/kg=9×109J
需要海水
2×1012J/9×109J=222.2;
(3)设完全燃烧300kg标准煤产生CO2为m
300kg标准煤中含碳:300kg×90%=270kg
C~CO2
12 44
270kg m
$\frac{12}{270kg}$=$\frac{44}{m}$
m=990kg.
故答案为:(1)轻核聚变;
(2)需要海水222.2L;
(3)设完全燃烧300kg标准煤产生CO2的质量为990kg.
点评 在解此类题时,首先分析题中考查的问题,然后结合俄知识和题中所给的知识进行解答.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①③④ | C. | ①②⑤⑥ | D. | ①②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
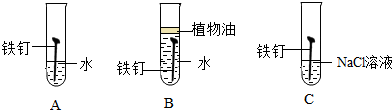
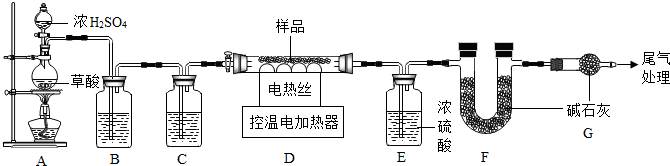
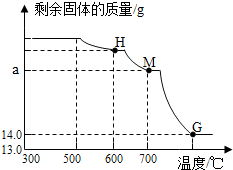
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
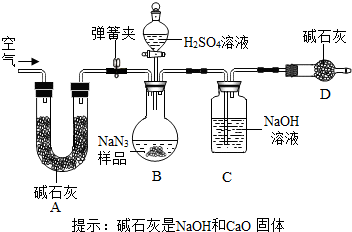 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com