
【题目】为了探究某稀盐酸中溶质的质量分数,甲、乙两同学分别取溶质质量分数相等的稀盐酸100g,甲同学向其中加入氧化铜8g,反应结束后观察到固体全部消失;乙同学向其中加入氧化铜16g,反应结束后观察到固体有剩余。下列有关实验的推断不正确的是( )
A.反应后乙同学所得溶液中一定不含盐酸
B.反应后向甲同学所得的溶液中滴加过量氢氧化钠溶液,一定会有蓝色沉淀生成
C.反应后甲、乙两同学所得的溶液中溶质的质量分数不一定相等
D.原稀盐酸中溶质的质量一定大于7.3克小于14.6克
【答案】D
【解析】
A、乙同学实验中氧化铜能与盐酸反应,生成氯化铜和水,氯化铜可溶于水,如果还有沉淀物,说明氧化铜还有剩余,盐酸全部反应,反应后乙同学的溶液中一定不含有盐酸,A表述正确;
B、甲同学实验中没有沉淀,说明氧化铜已经完全反应,盐酸还有剩余,若此时加入过量的氢氧化钠,在与盐酸全部反应完成后,剩余的氢氧化钠可以与氯化铜反应,生成不溶于水的氢氧化铜蓝色沉淀,B表述正确;
C、若8g氧化铜恰好与100g稀盐酸反应,那么此时甲会完全反应,乙会剩余8g氧化铜,此情况下,甲乙同学反应得到的溶液中溶质的质量分数完全一样;若8g氧化铜与100g盐酸反应盐酸有剩余,则16g氧化铜与盐酸反应后剩余的氧化铜的质量小于8g,此时甲乙两同学所得溶液中溶质的质量分数不相等,C表述正确;
D、若8g氧化铜恰好与盐酸完全反应,![]() ,此时需要7.3g盐酸,所以原稀盐酸中溶质的质量可以等于7.3g,D表述错误;
,此时需要7.3g盐酸,所以原稀盐酸中溶质的质量可以等于7.3g,D表述错误;
故选D。


科目:初中化学 来源: 题型:
【题目】小组同学查资料知道泡沫灭火器原理是:AlCl3+3NaHCO3=3NaCl +Al(OH)3↓+3CO2↑
(提出问题)此反应发生的原因是否由于AlCl3呈酸性?
(实验)测定AlCl3溶液的酸碱性
(1)用__________测定溶液的酸碱性。
(提出问题)NH4Cl溶液呈酸性,它是否也能与NaHCO3溶液反应?
(实验)按下图1进行实验:
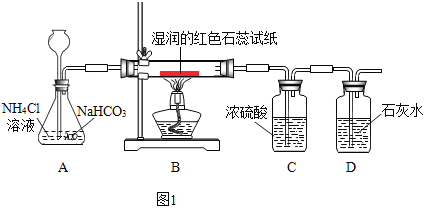
观察到的现象是:湿润的红色石蕊试纸变蓝,石灰水变浑浊
(2)C中浓硫酸的作用是________,D中石灰水的作用是_______。
(3)A中的反应化学方程式是_________。
(实验反思)Ⅰ、Na2CO3和 NaHCO3 的性质区别
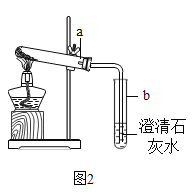
按图2进行实验:取适量的NaHCO3 粉末加到a试管中,加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊。持续加热直至两试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末。
(4)小文猜测白色固体粉末可能是:①NaOH;②Na2CO3;③NaCl.小燕认为猜想③一定不正确,理由是_______,小燕从试管内取少量白色固体溶于水,滴加酚酞,溶液变红,她判断该固体为NaOH,小美认为她的实验设计不合理,因为_________。
(5)他们继续探究固体成分,设计了如下实验:
操作步骤 | 实验现象 | 结论 |
取少量白色固体于试管中,加水溶解,向其中滴加足量_______溶液 | ______ | 剩余的固体有Na2CO3 |
静置,继续滴加酚酞 | 不变红 | 剩余的固体没有NaOH |
通过实验证明: 2NaHCO3 ![]() Na2CO3+ CO2↑ + H2O,NaHCO3热稳定性较Na2CO3差。
Na2CO3+ CO2↑ + H2O,NaHCO3热稳定性较Na2CO3差。
Ⅱ、泡沫灭火器中应用
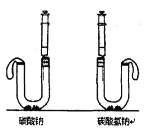
(6)按如图进行实验:U型管中分别加入等质量碳酸钠和碳酸氢钠固体,在两支注射器中分别吸入同溶质质量分数、同体积的足量稀盐酸,然后同时迅速将盐酸分别注入U型管中。____边U型管乳胶套膨胀更大,等质量碳酸钠和碳酸氢钠与盐酸反应生成的气体质量比是____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将一定质量的NaCl和Na2SO4固体混合物放入烧杯后,加入一定质量分数的BaCl2溶液208g,恰好完全反应,过滤,得到23.3g沉淀。经测定滤液中含氯元素的质量为21.3g(不考虑过滤过程中物质质量的损失)。计算:
(1)所加BaCl2溶液的溶质质量分数。
(2)原固体混合物中Na2SO4的质量。
(3)求反应后所得溶液的溶质的质量分数(计算结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一定质量的镁和一定量的锌分别与同浓度的稀硫酸恰好完全反应,产生的氢气体积和时间关系如图所示,下列结论不正确的是( )
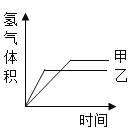
A.甲物质为锌,乙物质为镁
B.反应后消耗的硫酸质量相等
C.反应所消耗的镁和锌质量不相等,锌的质量大
D.反应速度是甲(锌)慢,乙(镁)快
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常用MnO2与浓盐酸反应制备Cl2,其反应方程式为:![]() 反应装置如图所示(夹持装置已略去)。
反应装置如图所示(夹持装置已略去)。
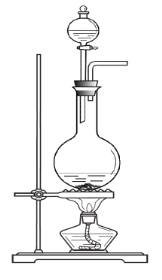
(1)检查装置气密性之后的操作依次是_____(填序号)。
A 向烧瓶中加入MnO2粉末
B 加热
C 向烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
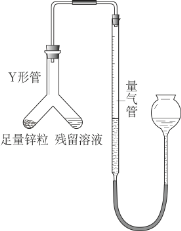
①甲同学的方案为:与足量AgNO3溶液反应,称量生成沉淀的质量。此方案_____(填“可行”或“不可行”),原因是_____。
②乙同学的方案为:与足量Zn反应,测量生成的气体体积。实验装置如图所示(夹持装置已略去)。使Y形管中的残余溶液与锌粒反应的正确操作是将_____。反应完毕,每间隔1分钟读取气体体积。气体体积逐渐减小,直至不变。气体体积逐渐减小的原因是_____(仪器和实验操作的影响因素除外)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图,A、B、C、D、E均为初中化学常见物质,它们存在如下转化关系,其中用“—”相连的表示两者可以反应,“→”表示生成的关系,一个字母代表一种物质。有部分生成物或反应物略去。
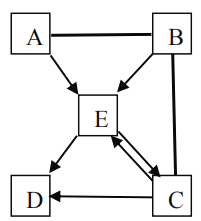
(1)若D和E为两种常见的金属单质,B、A是氧化物,E→C的化学方程式为_____。
(2)若C、D、E皆属于盐且都含有一种相同的元素、C在医疗上常用作补钙剂,B、E由两种元素组成,则E→C的化学方程式为_____,A物质的类别可能是_____(可多选:①单质②氧化物③碱④盐⑤酸)
(3)E→D可以生成一种难溶于稀硝酸的白色沉淀,写出反应方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上可利用黄铁矿(主要成分是Fe2S)煅烧的产物冶炼铁和生产硫酸,其反应方程如下:
① ②
②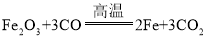 ③
③ ④
④![]()
下列说法不正确的是( )
A.反应①②③均有元素化合价发生变化
B.反应①②不属于四种基本反应类型中的任何一种,反应③④属于化合反应
C.将100g蒸馏水加入100g98%的浓硫酸中,可配制200g质量分数为49%的稀硫酸
D.将5gSO3溶于95g水形成溶液,其溶液中溶质的质量分数大于5%
查看答案和解析>>
科目:初中化学 来源: 题型:
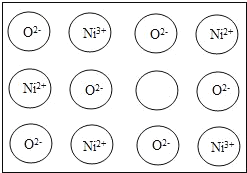
【题目】天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值都发生了变化。某氧化镍样品组成为Ni0.97O,则该晶体中Ni3+与Ni2+的离子数之比为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】仔细阅读某试剂瓶上的标签,并回答下列有关问题:
过氧化氢溶液
[含量]过氧化氢的质量分数为30%
[密度]1.1g/cm3
[性状]无色透明液体;本身不能燃烧,但能与可燃物反应放出大量热量和氧气而引起着火爆炸;过氧化氢在pH为3.5-4.5时较稳定;遇光、热易分解。
[用途]………。
[贮藏]………。。
(1)过氧化氢在_____填(“酸性”、“碱性”或“中性”)溶液中较稳定。
(2)贮藏该过氧化氢溶液时应注意:①避光低温保存;②_____。
(3)若配制100mL3.3%(密度近似为1g/cm3)的过氧化氢溶液,则需要该溶液_____mL。
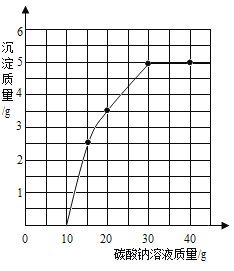
(4)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示。
回答下列问题:
①开始加入碳酸钠溶液至10g时,还没有沉淀的原因是_____。
②计算原滤液中氯化钙的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com