【答案】
分析:(1)根据测定空气中氧气的含量的实验注意事项进行分析解答.
(2)根据各实验的目的、装置、药品、操作过程及结论进行分析判断.
(3)根据铁锈生锈的条件、二氧化碳的化学性质进行分析解答.
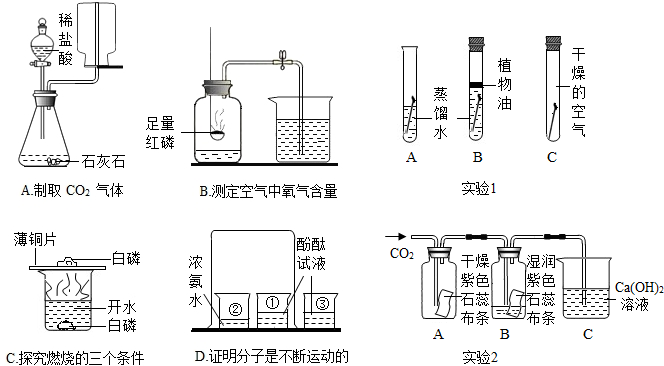
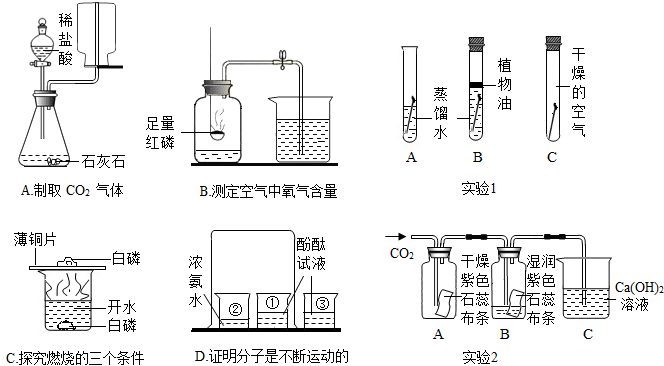
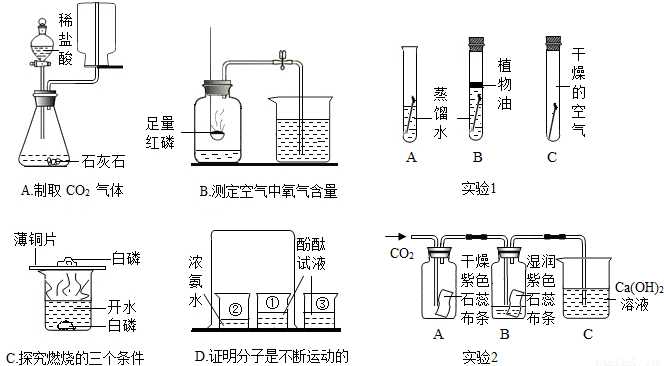
解答:解:(1)B实验的实验目的是证明氧气的体积约占空气总体积的

;实验成功的关键与许多因素有关,如果装置漏气、实验前未夹紧止水夹、红磷的量不足、未冷却后再打开止水夹都是使测得结果偏小,故①②③操作妥当;操作不妥的是用硫粉代替红磷,因为硫和氧气反应生成二氧化硫气体,瓶内气体体积不变,无法测定.
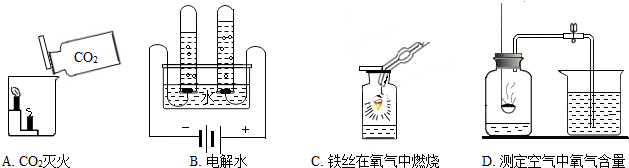
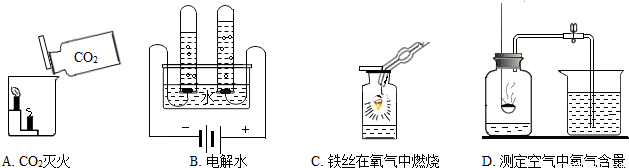
(2)A、二氧化碳的密度比空气大,应用向上排空气法收集,因此A不能达到实验目的.
B、从所用药品和实验装置进行分析,因此B实验能达到实验目的.
C、从燃烧的三个条件进行分析,两处的实验现象只能证明燃烧与是否与氧气接触有关,不能证明燃烧与温度是否达到着火点有关,因此不能达到实验目的.
D、根据烧杯①中的酚酞溶液变红色,烧杯②中的酚酞溶液不变色,从实验操作步骤和现象进行分析,此实验可以得出分子是在不断的运动的,可达到实验目的.
(3)铁生锈的条件是与空气中的水和氧气反应,A中的铁钉与空气和水同时接触,所以实验1中最易生锈的是A中的铁钉.
生活中使用过的菜刀、铁锅等铁制品,清洗后需要及时擦干放置,可以减少水对铁锈蚀的影响.
实验2中二氧化碳与水反应生成碳酸,反应的化学方程式为:H
2O+CO
2═H
2CO
3;当二氧化碳进入C后,与石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为:CO
2+Ca(OH)
2═CaCO
3↓+H
2O.
故答案为:(1)④;(2)BD;(3)A;水;H
2O+CO
2═H
2CO
3;CO
2+Ca(OH)
2═CaCO
3↓+H
2O.
点评:本题难度不大,掌握实验室制取二氧化碳的方法、测定空气中氧气的含量的实验、燃烧的条件、分子的性质、铁生锈的条件、二氧化碳的化学性质是正确解答本题的关键.

 ;实验成功的关键与许多因素有关,如果装置漏气、实验前未夹紧止水夹、红磷的量不足、未冷却后再打开止水夹都是使测得结果偏小,故①②③操作妥当;操作不妥的是用硫粉代替红磷,因为硫和氧气反应生成二氧化硫气体,瓶内气体体积不变,无法测定.
;实验成功的关键与许多因素有关,如果装置漏气、实验前未夹紧止水夹、红磷的量不足、未冷却后再打开止水夹都是使测得结果偏小,故①②③操作妥当;操作不妥的是用硫粉代替红磷,因为硫和氧气反应生成二氧化硫气体,瓶内气体体积不变,无法测定.