
| A. | 7.3% | B. | 0.73% | C. | 1.46% | D. | 无法计算 |
分析 氯化钡和稀硫酸反应生成硫酸钡沉淀和盐酸,反应前后的质量差即为反应生成沉淀硫酸钡的质量,根据硫酸钡质量可以计算反应生成的氯化氢质量,进一步可以计算稀盐酸中溶质的质量分数.
解答 解:设反应生成氯化氢质量为x,
反应生成硫酸钡质量为:32.33g+20g-50g=2.33g,
BaCl2+H2SO4═BaSO4↓+2HCl,
233 73
2.33g x
$\frac{233}{2.33g}$=$\frac{73}{x}$,
x=0.73g,
该溶液中氯化氢的质量分数为:$\frac{0.73g}{50g}$×100%=1.46%,
故选:C.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
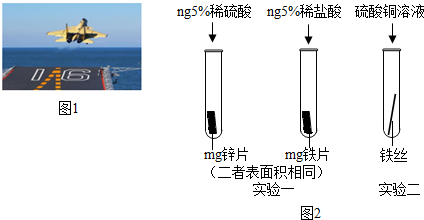
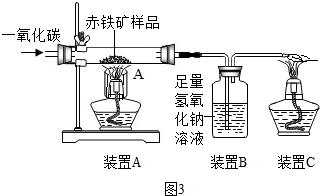
| 实验步骤 | 实验现象 | 实验结论 |
| 分别取少量硫酸铜溶液、硫酸锌溶液于两支试管中,将铁丝分别浸入两溶液中,观察现象 | 浸入硫酸铜溶液中的铁丝表面出现红色固体,溶液由蓝色逐渐变为浅绿色;浸入硫酸锌溶液的铁丝无明显变化 | 金属活动性顺序: Zn>Fe>Cu |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| O | Mg | S | Cl |
 | 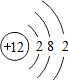 | 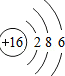 | 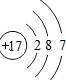 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若丙、丁为盐和水,则甲和乙一定是酸和碱 | |
| B. | 若甲为10克、乙为20克,反应后生成的丙和丁的质量和一定为30克 | |
| C. | 若该反应为复分解反应,则生成物中一定有水 | |
| D. | 若甲和丙为单质、乙和丁为化合物,则该反应一定为置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
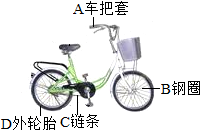 为减少传统燃油汽车的尾气污染,南通近期投入了一批液化天然气公交车、电动公交车和公共自行车?
为减少传统燃油汽车的尾气污染,南通近期投入了一批液化天然气公交车、电动公交车和公共自行车?查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
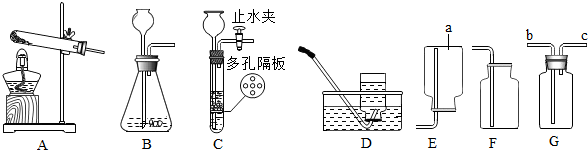
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com