
【题目】如下图所示,实验小组用微型实验装置“W”型玻璃管探究燃烧的条件。
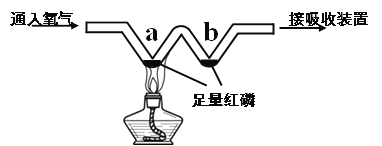
(1)a处反应的化学方程式为___________。
(2)对比a、b处的实验现象,可知可燃物燃烧的条件之一是______________。
(3)若验证可燃物燃烧的另一个条件,还需补充的实验操作是_____________。
【答案】 4P+5O2![]() 2P2O5 温度达到着火点 停止通入氧气,改通氮气
2P2O5 温度达到着火点 停止通入氧气,改通氮气
【解析】 (1)a处发生的反应是磷和氧气点燃条件下生成五氧化二磷,化学方程式为4P+5O2 ![]() 2P2O5 ;(2) 燃烧是可燃物与氧气充分接触发生的发光、放热的剧烈的氧化反应。燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;对比a处温度较高的红磷能燃烧、b处温度较低的红磷不燃烧,可知可燃物燃烧的条件之一是温度达到可燃物的着火点;(3)若验证可燃物燃烧的另一个条件:可燃物与氧气充分接触,还需补充的实验操作是停止通入氧气,改通氮气,发现红磷不燃烧,与通氧气时磷燃烧对比即可获得结论。
2P2O5 ;(2) 燃烧是可燃物与氧气充分接触发生的发光、放热的剧烈的氧化反应。燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;对比a处温度较高的红磷能燃烧、b处温度较低的红磷不燃烧,可知可燃物燃烧的条件之一是温度达到可燃物的着火点;(3)若验证可燃物燃烧的另一个条件:可燃物与氧气充分接触,还需补充的实验操作是停止通入氧气,改通氮气,发现红磷不燃烧,与通氧气时磷燃烧对比即可获得结论。


 寒假学与练系列答案
寒假学与练系列答案科目:初中化学 来源: 题型:
【题目】载人航天器工作舱中的空气要与地球上的空气基本一致。已知:在同温同压下,气体的体积之比等于分子个数之比。
(1)若用“![]() ”表示氮原子,“
”表示氮原子,“![]() ”表示氧原子,请在方框内用微观示意图表示工作舱中空气的主要成分。___________________。
”表示氧原子,请在方框内用微观示意图表示工作舱中空气的主要成分。___________________。
(2)宇航员呼出的CO2用氢氧化锂(LiOH)吸收,生成Li2CO3和H2O,反应的化学方程式为_______。
【答案】  CO2 + 2LiOH ==== Li2CO3 + H2O
CO2 + 2LiOH ==== Li2CO3 + H2O
【解析】本题考查了空气的成分等。
(1)空气中氮气和氧气应该均匀分布,且氮气与氧气的体积比约为4:1,用微观示意图表示工作舱中空气的主要成分,如图:
(2)宇航员呼出的CO2用氢氧化锂(LiOH)吸收,生成Li2CO3和H2O,反应的化学方程式为:CO2 + 2LiOH ==== Li2CO3 + H2O。
【题型】填空题
【结束】
20
【题目】阅读下面科普短文。
在中国古代化工发展的历史征程中,我国古代先民们在火药、制陶烧瓷、炼铜冶铁等化学加工技术方面取得了许多非凡的成就,为促进我国古代社会发展和人类的进步做出了重大的贡献。
【火药】人类最早使用的火药是黑火药,主要反应如下:

【制陶烧瓷】瓷器与陶器,都属于硅酸盐系列制品,最主要的化学成分是二氧化硅(SiO2)、氧化铝(Al2O3)及多种金属(Ca、Mg、Fe、K、Na等)氧化物。但在化学成分含量、用途等方面却大有区别。
制品 | 化学成分 | 性能用途等 |
陶器 | Al2O3 约15%~18%; Fe2O3约5%~6%; CaO、MgO等≥3%。 | 粗糙,不够坚硬,常用于取水、盛放食物等。 |
瓷器 | Al2O3 约18%~28%; Fe2O3约1%~2%; CaO、MgO等≤1%。 | 高温烧结,坚硬致密,洁白,薄, 呈半透明,敲击时清脆悦耳,美观,用途广泛,观赏、收藏价值高等。 |
【金属冶炼】制陶发展起来的高温技术为金属的冶炼、熔铸创造了条件,我国由新石器时代晚期逐步进入了先是炼铜(称为“青铜器时代”)后是炼铁(称为“铁器时代”)的金属时代。
青铜冶炼
天然铜夹杂在铜矿石之中,人们在加热熔化天然铜的过程中,将绿色的孔雀石[Cu2(OH)2CO3]、棕或黑色的锡石(SnO2)、蓝色的方铅矿(PbS)放在一起烧,便产生了青铜。青铜是铜与锡或铅熔成的合金。熔点比纯铜(1083℃)低100℃~300℃,更易加工和铸造,铸造性能也比纯铜好,硬度几乎提高一倍,适合制作工具和兵器。
铁的冶炼
到了春秋中后期,我国先民们在熟悉地掌握了块炼法炼铁后,又在世界上率先发明了以高温液体还原法冶炼生铁的技术,这在冶金史上是一个划时代的进步。
随着炼铁技术的进步,人们也逐渐懂得了炼钢。生铁和钢都是铁碳合金。含碳量>2%,为生铁;含碳量<0.02%,为纯铁;含碳量在两者之间为钢。依据文章内容回答下列问题。
(1)黑火药的主要成分是________。
(2)陶器与瓷器化学成分的主要区别是_________。
(3)生铁的碳含量______(填“高于”或“低于”)钢的碳含量。
(4)与纯金属相比,合金的优点可能是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图表法是一种常用的数据处理方法。结合所给图表回答下列问题:
氢氧化钠、碳酸钠分别在水、酒精中的溶解度如下表所示
氢氧化钠 | 碳酸钠 | |||
20℃ | 40℃ | 20℃ | 40℃ | |
水 | 109 g | 129 g | 21.8 g | 49 g |
酒精 | 17.3 g | 40 g | 不溶 | 不溶 |

(1)上述图像表示________(填“氢氧化钠”或“碳酸钠”)的溶解度曲线。
(2)20℃时,氢氧化钠的溶解度_______(填“大于”或“小于”)碳酸钠。
(3)40℃时,若将50 g NaOH分别投入到100 g水和100 g酒精中,能形成饱和溶液的是_______,再将CO2通入所得NaOH的酒精溶液中,观察到的现象为_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲醇( CH3OH )是一种有毒,有酒的气味的可燃性液体。甲醇在氧气中不完全燃烧可发生如下反应: 8CH3OH+nO2![]() mCO2+2CO + 16H2O。若反应生成3.6g 水,请计算:
mCO2+2CO + 16H2O。若反应生成3.6g 水,请计算:
①m值是____;
②参加反应的氧气质量是________克?(写出规范计算步骤)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文(原文有删改)
食盐
食盐是生活中常用的调味品,主要成分是氯化钠,在人体中有调节水分、维持酸碱平衡等生理作用。
资料一:食盐的加工
工业上用海水晒盐或用盐湖水、盐井水煮盐,使氯化钠晶体析出。这样制得的氯化钠含有较多的杂质,称为粗盐。粗盐经下图所示主要流程可成为精盐。

资料二:食盐的种类
市面上食盐制品种类繁多,现简要介绍几种。原盐,即粗盐,常用于腌制工艺;精盐,由粗盐提纯而成,适合烹饪调味;碘盐,在食盐中添加一定量碘酸钾(KIO3)即为碘盐,可防治碘缺乏病;低钠盐,食盐中添加氯化钾、硫酸镁等有“咸味”的成分,可防治因钠离子摄入过多而引起的高血压等疾病。
资料三:食盐的摄入量
虽然我们的身体离不开食盐,但摄入过多也会对身体产生危害。按照世界卫生组织的推荐标准,成人每天食盐摄入量不宜超过6g。然而据调查,我国人均每天的食盐摄入量为9.1g。一方面三餐中食盐量需要控制,另一方面,许多成品食物中食盐的含量也应引起重视,下表所示为部分成品食物每100g中的食盐含量。
食品 | 某品牌方便面 | 某品牌酱油 | 某品牌薯片 |
食盐含量g/100g | 3 | 16 | 1.6 |
依据文章内容回答下列问题。
(1)由粗盐制得精盐的过程属于_________(填“物理”或“化学”)变化。
(2)成人每天食盐摄入量不宜超过_____________g。
(3)如果某人一天吃了两袋(共300g)上表中所示方便面,按照世界卫生组织推荐标准,其当天食盐摄入量________(填“超标”或“未超标”)。
(4)下列关于食盐的说法正确的是_________。
A.高血压患者,可适当选择低钠盐
B.目前我国居民食盐摄入量普遍偏高
C.氯化钠是维持人体生命活动的重要物质
D.为补充人体所需钠元素和氯元素,每天做饭时可加入大量食盐
(5)请你为人们提一条日常摄取食盐的建议:_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-和SO42-离子的一种或几种。为确定溶液中可能存在的离子,进行下面实验。
①经测定,溶液的PH=1;
②取部分样品滴加NaOH溶液,有沉淀生成。继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的滤液中继续滴加Na2CO3溶液,又观察到沉淀生成.分析实验得到的以下结论中,正确的是( )。
A. 溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、SO42-
B. 溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有Na+、OH-和SO42-
C. 溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有OH-、SO42-,可能含有Na+
D. 溶液中一定含有H+、Ba2+、Na+、Fe3+,一定不含有OH-、SO42-,可能含有Cl-
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家发现,利用催化剂可有效消除室内装修材料释放的甲醛,其反应微观示意图如下。下列有关该反应的说法正确是( )
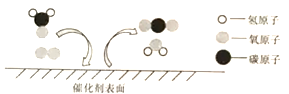
A.属于置换反应 B.可解决甲醛带来的室内空气污染问题
C.其中甲醛属于氧化物 D.化学方程式为:HCO+O2= CO2+H2O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某小组对石灰石进行煅烧,并对煅烧后固体成分进行探究。
(1)写出此反应的化学方程式_______________________。 (2)根据化学方程式进行猜想。固体残留物成分: I. 只有氧化钙;II. 只有碳酸钙;III. _____________ (3)甲乙丙三位同学分别设计了三种方案探究煅烧后固体成分。 友情提示:①CaO+2HCl→CaCl2+H2O; ②Ca(OH)2+2HCl→CaCl2+2H2O ③氯化钙溶液呈中性。 | |||||
方案设计 | 操作及现象 | 实验结论 | 解释 | ||
方案一 |
| 固体物质中 一定含有_______ | 用化学方程式解释判断理由_______。 | ||
方案二 |
| 乙同学得出 猜想II成立 | 该同学设计方案是否合理,理由是______。 | ||
方案三 |
| 猜想III成立 | |||
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组设计了如下实验来探究影响锌与稀硫酸反应速率的因素(实验过程中杂质不能与稀硫酸反应),实验数据记录如下表:
实验编号 | 试剂 | 产生50mL氢气 的时间/s | ||
不同纯度的锌 | 稀硫酸的浓度 | 稀硫酸的用量/ mL | ||
a | 纯锌 | 30% | 30 | 52 |
b | 含杂质的锌 | 30% | 30 | 47 |
c | 纯锌 | 20% | 30 | 68 |
d | 纯锌 | 30% | 40 | 50 |
(1)实验_____和实验______(填实验编号)的实验目的是为了研究硫酸浓度对反应速率的影响。
(2)对比实验a和实验b,可以得到的实验结论是____________________。
(3)计算9.8g纯硫酸与足量的锌完全反应,可制得氢气是_________克?请你帮他们完善计算过程:
①______________②____________________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com