
【题目】实验室用含杂质的锌运稀硫酸反应制取氢气,取8g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入74.2g稀硫酸,恰好完全反应后烧杯内剩余物质的质量为82g.计算:
(1)杂质的质量g.
(2)反应后所得溶液的溶质质量分数(请写出计算过程)
【答案】
(1)1.5
(2)
解:根据质量守恒定律,反应放出氢气的质量=74.2g+8g﹣82g=0.2g;
设参与反应的锌的质量为x,生成硫酸锌的质量为y,
Zn+H2SO4= | ZnSO4+ | H2↑ |
65 | 161 | 2 |
x | y | 0.2g |
![]()
x=6.5g
y=16.1g
完全反应后生成物溶液中溶质的质量分数为: ![]() × 100%=20%
× 100%=20%
答:反应后所得溶液的溶质质量分数为20%。
【解析】根据质量守恒定律,反应放出氢气的质量=74.2g+8g﹣82g=0.2g;
设参与反应的锌的质量为x,生成硫酸锌的质量为y,
Zn+H2SO4= | ZnSO4+ | H2↑ |
65 | 161 | 2 |
x | y | 0.2g |
![]()
x=6.5g
y=16.1g
(1)杂质的质量=8g﹣6.5g=1.5g(2)完全反应后生成物溶液中溶质的质量分数为:![]() × 100%=20%答案:(1)1.5;(2)反应后所得溶液的溶质质量分数为20%.
× 100%=20%答案:(1)1.5;(2)反应后所得溶液的溶质质量分数为20%.
根据质量守恒定律,由反应前后物质的总质量的差求得反应放出氢气的质量;
利用锌与稀硫酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出参与反应的锌的质量(即样品中锌的质量)和生成硫酸锌的质量.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:初中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.在蛋白质溶液中加入饱和硫酸铵溶液有沉淀析出
B.“加铁酱油”中的“铁”指的是离子
C.通常把pH<7的降水称为酸雨
D.尿素〔CO(NH2)2〕及碳酸氢铵都是有机物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】固体化合物A由两种元素组成,化合物B是盐.为了确定它们的成份,各取适量两种固体粉末混合均匀,按以下步骤进行实验并记录了实验流程: 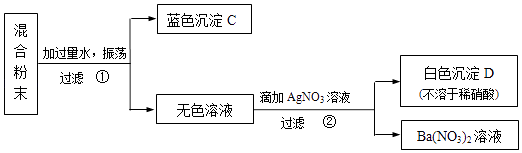
根据实验现象回答:
(1)判断化合物A的化学式为 .
(2)写出步骤②发生反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com