

| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 | 产生大量的气泡 | 该溶液是 ,反应的化学方程式 |

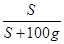 ×100﹪,可知20℃时其饱和溶液的溶质质量分数=
×100﹪,可知20℃时其饱和溶液的溶质质量分数=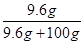 ×100﹪=8.8%,小于10%,所以不可能是碳酸氢钠。
×100﹪=8.8%,小于10%,所以不可能是碳酸氢钠。

科目:初中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 实验步骤 | 实验现象 | 结论 |
| ①向烧杯中加入10mL氢氧化钠溶液,并滴入几滴酚酞试液 ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液。 | ①溶液颜色 ; ②不断搅拌溶液至溶液颜色变成 色。 | 酸和碱发生了中和反应 |
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 甲同学的方案 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 乙同学的方案 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好完全反应 |
| 丙同学的方案 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
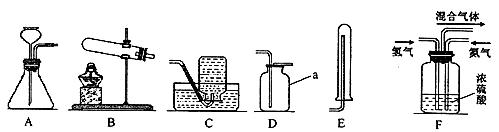
 ;已知:同温同压下气体的体积比等于气体的分子数之比)。实验室模拟合成氨气的流程如下:
;已知:同温同压下气体的体积比等于气体的分子数之比)。实验室模拟合成氨气的流程如下: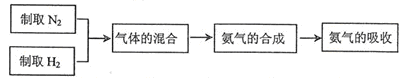
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 实验步骤 | 实验现象 | 反应的方程式 |
| | | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
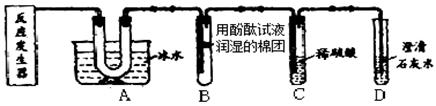
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
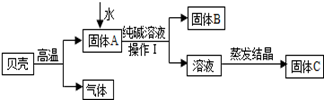
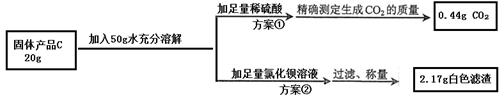
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 现象 | 结论或化学方程式 |
| 步骤Ⅰ:取少量硬水样品于试管中,向其中滴加Ca(OH)2溶液,直到反应完全。 | 有白色沉淀产生。 | MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 |
| 步骤Ⅱ:向上述试管中滴加 溶液,直到反应完全。 | | 化学方程式: |
| 步骤Ⅲ: (填操作 名称)。 | 除去沉淀物。 | 得到澄清滤液。 |
| 步骤Ⅳ:用两试管取等量的上述滤液和原硬水样品,分别滴加 ,振荡。 | 盛有滤液的试管中 。 | 证明硬水已软化。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com