
【题目】合理使用化肥可提高农作物产量。下图是生产尿素的微观示意图。回答问题。
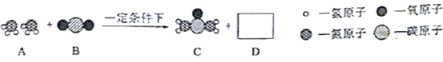
(1)A物质中氮元素的化合价是_____。D物质的化学式是_____。
(2)下列与尿素不属于同类肥料的是_____。
A.NH4HCO3 B.NH4Cl C.K2SO4
科目:初中化学 来源: 题型:
【题目】下图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是
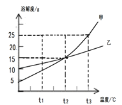
A. 乙中含有少量甲,可用冷却热饱和溶液的方法提纯甲
B. t3℃时,甲的溶液溶质质量分数一定大于乙的溶液溶质质量分数
C. t3℃时,将等质量的甲、乙两种物质的饱和溶液分别降温至t2℃,析出晶体的质量甲一定大于乙
D. t1℃时,乙的不饱和溶液只有通过蒸发溶剂的方法才能转变成饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】汽车尾气催化转换器可减少有害气体的排放,其中某一反应过程的微观变化如图所示。请回答下列问题:
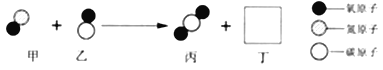
(1)化学反应前后:物质总质量是否发生改变? _____ (选镇“是”或“否”);种类发生改变的微粒是_____ ( 选填“分子”或“原子”)。
(2)丙微粒中碳元素的化合价为___________。
(3)已知丁是一种单质,则丁是_________ ( 写化学式)。
(4)该反应的化学方程式为____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
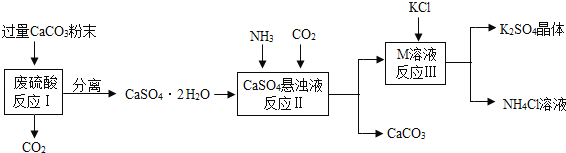
【题目】某实验小组利用废硫酸液制备K2SO4并研究CaSO42H2O加热分解的产物。
(一)K2SO4的制备
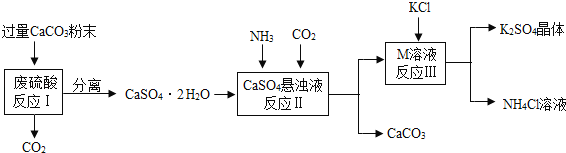
(1)将CaCO3研成粉末的目的是___________________________________。
(2)M物质的化学式为__________。
(3)反应Ⅲ中相关物质的溶解度如下表。
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下能实现的原因是_______________________________________。
(4)上述流程中可循环使用的物质有CO2和_____________(填写化学式)。
(二)研究CaSO42H2O加热分解的产物
(5)分离出的CaSO42H2O中常含有CaCO3,可用盐酸除去CaCO3,
该反应的化学方程式_______________________________________________。
(6)为了测定CaSO42H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验。注:碱石灰的主要成分为NaOH和CaO。
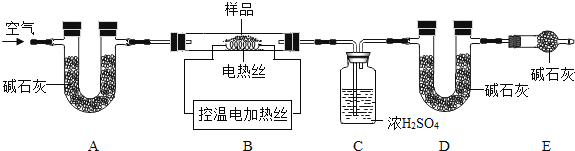
① 实验前首先要________________,再装入样品。装置A的作用是_________________。
② 已知:CaSO42H2O在160℃生成CaSO4,1350℃时CaSO4开始分解; CaCO3在900℃时分解完全。
现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将______。(填“偏大”、“偏小”或“无影响”)你认为还可选用上述的________________(选填序号)两个数据组合也可求出x:y的值。
(7)CaSO42H2O受热会逐步失去结晶水。取纯净CaSO42H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示。
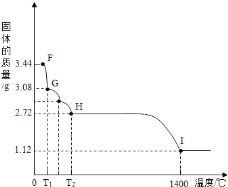
则G点固体的化学式是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某实验小组利用废硫酸液制备K2SO4并研究CaSO42H2O加热分解的产物。
(一)K2SO4的制备
(1)将CaCO3研成粉末的目的是___________________________________。
(2)M物质的化学式为__________。
(3)反应Ⅲ中相关物质的溶解度如下表。
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下能实现的原因是_______________________________________。
(4)上述流程中可循环使用的物质有CO2和_____________(填写化学式)。
(二)研究CaSO42H2O加热分解的产物
(5)分离出的CaSO42H2O中常含有CaCO3,可用盐酸除去CaCO3,
该反应的化学方程式_______________________________________________。
(6)为了测定CaSO42H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验。注:碱石灰的主要成分为NaOH和CaO。
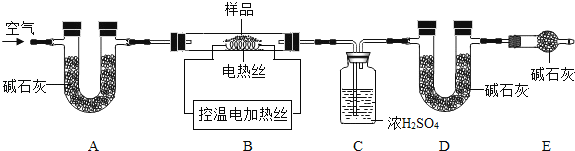
① 实验前首先要________________,再装入样品。装置A的作用是_________________。
② 已知:CaSO42H2O在160℃生成CaSO4,1350℃时CaSO4开始分解; CaCO3在900℃时分解完全。
现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将______。(填“偏大”、“偏小”或“无影响”)你认为还可选用上述的________________(选填序号)两个数据组合也可求出x:y的值。
(7)CaSO42H2O受热会逐步失去结晶水。取纯净CaSO42H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示。
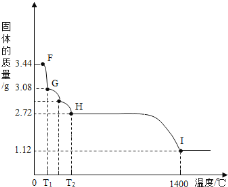
则G点固体的化学式是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下表列出了部分元素原子结构示意图。下列叙述错误的是
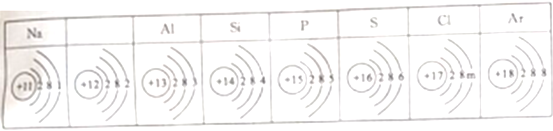
A. 在不显电性的情况下,表中m的值为7
B. 如果失去第三层电子,上表空格内的微粒符号可表示为Mg2+
C. 上表中所列元素在元素周期表中属于同一周期
D. 钠原子在化学反应中易得电子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是A、B、C三种固体物质的溶解度曲线,请根据图示回答:
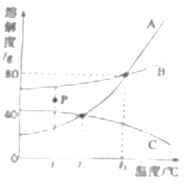
(1)t3℃时,将60gB物质加入到50g水中,充分搅拌后,所得溶液的质量是_________g。
(2)图中P点所表示的B物质的溶液为_________(填“饱和”或“不饱和”)溶液,欲将t1℃时C物质的不饱和溶液变为饱和溶液,可采用的方法是__________(任写一种)。
(3)将t2℃时A、B、C三种物质的饱和溶液分别升温到t3℃(忽略水的蒸发),三种溶液的溶质质量分数由大到小的顺序是___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用适当的化学方程式说明或解释下列问题:
(1)用石灰浆粉刷墙面,干燥后变得坚硬_______________________________
(2)服用Al(OH)3的药丸治疗胃酸过多症_________________________
(3)生活中铝锅表面易形成有较强的抗腐蚀性的氧化膜 _____________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了探究金属与酸反应的规律,某实验小组进行了如下实验,取等质量的铁片、镁片、锌片,分别与等体积、等浓度的稀盐酸反应,用温度传感器测得反应温度变化曲线如下图所示。
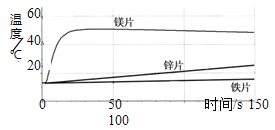
(1)请分析反应中温度升高的原因:_________________ ;
(2)根据曲线总结出金属活动性的相关规律:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com