
向50g Na2CO3溶液中逐滴加入一定溶质质量分数的CaCl2溶液。实验过程中,生成沉淀质量与加入CaCl2溶液的质量关系如右图所示,试计算:
(1)恰好完全反应时,生成沉淀的质量为______________g。
(2)计算恰好完全反应时,所得溶液中溶质的质量分数。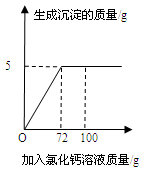
(1) 5;(2)5%
解析试题分析:(1)由图像可知,恰好完全反应时,生成沉淀的质量为5g;(2)已知量:50g碳酸钠溶液;72g氯化钙溶液,沉淀碳酸钙5g,反应方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl;未知量为:所得溶液中溶质质量,所得溶液的质量;思路分析:由恰好反应时生成沉淀的质量结合化学方程式可以计算所得溶液中溶质氯化钠的质量; 设:生成氯化钠的质量为x,
Na2CO3+CaCl2=CaCO3↓+2NaCl (1分)
100 117
5g x
100:117=5g:x (1分)
x=5.85g (1分)
所得溶液的溶质质量分数=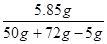 ×100%=5% (2 分)
×100%=5% (2 分)
答: 略。
注: 设未知量和答,错写或漏写扣一分;写对不得分。
计算所得溶液溶质质量分数,列式正确得1分,计算结果正确得1分,共计2分.
考点: 图像题;化学方程式计算


科目:初中化学 来源: 题型:单选题
向溶质的质量分数为17%的硝酸银溶液中逐滴滴入稀盐酸,测得滴入盐酸的质量与生成沉淀的质量有如图所示关系,则恰好完全反应时所得溶液中溶质的质量分数为
| A.6.3% | B.7.3% | C.10% | D.17% |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
人体缺乏维生素C(简写Vc)会患坏血病。下图所示为某种“维生素C”说明书的一部分,请回答:
(1)Vc中C、H、O三种元素的质量比是 。
(2)若正常成人每天对Vc的最低需要量为60mg。
①当这些Vc完全来自右图的“维生素C”时,则每次服用“维生素C”至少 片;
②当这些Vc完全来自某种新鲜蔬菜(每1000g这种蔬菜含Vc120mg)时,每天至少应食用这种蔬菜 g。
③维生素C又名抗坏血酸,其水溶液能使紫色石蕊试液变 色。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
向20g赤铁矿样品中(样品中杂质不溶于水,也不和酸反应)不断加入稀盐酸至固体量不再减少为止,共消耗稀盐酸184g,测得剩余固体的质量为4g。请计算:
(1)赤铁矿样品中,氧化铁的质量分数
(2)最后所得溶液中溶质的质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(5分)鸡蛋壳的主要成分是碳酸钙.小明同学为了测定鸡蛋壳中碳酸钙的质量分数,分别设计了如下实验并进行计算.将鸡蛋壳洗净、干燥并捣碎后放入锥形瓶里,加入足量的稀盐酸充分反应(假设其他杂质不与盐酸反应).
测得相关数据如图所示:
【数据处理】
(1)反应生成二氧化碳的质量为 g.
(2)请帮小明计算鸡蛋壳中碳酸钙的质量分数,并写出计算过程:
实验过程如果有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比 (填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示。当滴入碳酸钠溶液至图中A点时,通过计算确定所得溶液是否为饱和溶液。(提示:20℃时,氯化钠溶解度为36克。)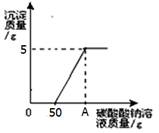
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(5分)哈南新城在地铁建设中需要大量的钢铁,现有赤铁矿样品(所含杂质不溶于水也不与酸反应),实验小组同学为测定其纯度,
进行了三次实验,实验数据如下表所示。请回答下列问题:
| | 第1次 | 第2次 | 第3次 |
| 样品质量(g) | 25 | 30 | 25 |
| 盐酸质量(g) | 200 | 100 | 100 |
| 所得溶液质量(g) | 216 | 116 | 116 |
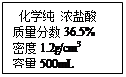
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(6 分)镁是一种用途广泛的金属材料,目前大部分镁都是利用从海水中提取的镁盐 制取的。某校化学活动小组欲测定海水中氯化镁的含量,取海水样品 200g,加入适量 氢氧化钠溶液,至恰好完全反应为止,称量所得沉淀物的质量为 0.58g。 请你根据上述资料,回答下列问题:
⑴金属镁的物理性质有: 。(答出一条即可)
⑵查阅资料可知,海水中镁元素的含量比较低,所以,从海水中提取 MgCl2 时, 经历了“MgCl2 → Mg(OH)2 → MgCl2”的转化过程,请分析这样做的目的是
⑶列式计算:上述 200g 海水样品中,所含 MgCl2 的质量是多少?
(提示:MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl )
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数。
Ⅰ.甲同学取一定质量的赤铁矿粉与过量的木炭粉混合后,用下图所示装置以合理的操作步骤测定(假设杂质始终不发生变化);反应生成单质铁和二氧化碳,以及少量的一氧化碳。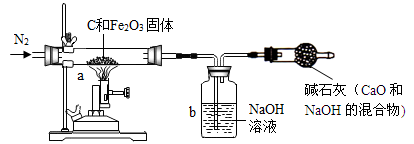
(1) 实验中持续通入干燥的氮气。加热前缓缓通入一段时间,其作用是 。
(2)反应结束后,甲同学熄灭了喷灯的火焰后,马上停止通入N2,他这样操作引起的后果
是 。
(3)如果b装置中氢氧化钠溶液对二氧化碳的吸收是完全的,那么甲同学用b装置中氢氧
化钠溶液的质量变化测定出氧化铁的质量分数将 (选填“偏大”、“偏小”
或“准确”)。
Ⅱ.乙同学取氧化铁的质量分数为80%的赤铁矿粉10g,加入足量稀盐酸,恰好完全反应,
共用去稀盐酸154.5g(假设杂质既不溶于水也不与酸发生反应)。
试计算反应后溶液中溶质的质量分数。(请写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com